
【题目】化学能与电能可相互转化,根据下图回答问题。

(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的____________棒。(填“铁”或“碳”)
②乙装置中阳极上发生的电极反应式为________________________。
(2)若两装置中均为饱和NaCl溶液:
①甲装置中碳棒上电极反应属于_________________(填“氧化反应”或“还原反应”)。
②乙装置中反应的化学方程式为 __________________。
③若乙装置转移0.1mole-后停止实验,且溶液体积为1L,则溶液混匀后的c(OH-)=_____。(不考虑所生成气体在溶液中的溶解)
【答案】碳 铁 4OH--4e-=O2↑+2H2O或2H2O-4e- = O2↑+ 4H+ 还原反应 2NaCl+2H2O ![]() Cl2↑+H2↑+2NaOH 0.1mol/L
Cl2↑+H2↑+2NaOH 0.1mol/L
【解析】
(1)甲为原电池,Fe为负极,乙为电解池,Fe为阴极,据此分析判断;②乙中阳极上氢氧根离子放电,据此分析书写电极反应式;
(2)①甲中碳为正极;②电解NaCl溶液生成NaOH、氢气、氯气;③根据②的反应方程式分析解答。
(1)①甲为原电池,Fe为负极,总反应为Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O或2H2O-4e- = O2↑+ 4H+,故答案为:4OH--4e-=O2↑+2H2O或2H2O-4e- = O2↑+ 4H+;
(2)①甲中碳为正极,正极上氧气得电子发生还原反应,故答案为:还原反应;
②电解NaCl溶液生成NaOH、氢气、氯气,反应的化学方程式为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH;
Cl2↑+H2↑+2NaOH;
③根据2Cl-+2H2O ![]() 2OH-+H2↑+Cl2↑知,c(OH-)=
2OH-+H2↑+Cl2↑知,c(OH-)=![]() ×2=0.1mol/L,故答案为:0.1mol/L。
×2=0.1mol/L,故答案为:0.1mol/L。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
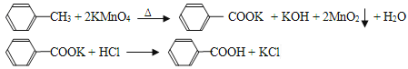
己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。

i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________________________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. 100mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是____________________________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯
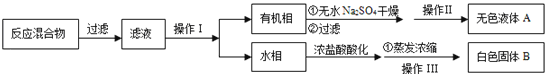
(3)含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________;操作Ⅰ的名称是___________。
iii纯度测定
(4)称取1.220g产品,配成100ml甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应).重复三次,平均每次消耗KOH溶液的体积23.00mL。样品中苯甲酸纯度为_______。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物。应采用___________法对样品提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
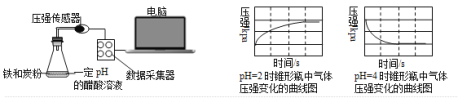
分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。
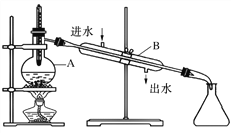
(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芝加哥伊利诺伊大学的研究人员设计了一种可用于商业化的新型锂金属电池,电池结构如图所示: 电池工作时,下列说法错误的是
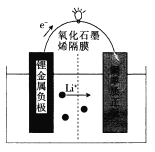
A. 该装置将化学能转化为电能
B. 负极上发生的电极反应为Li- e-= Li+
C. 该电池可用LiOH溶液作电解质
D. 电池工作时,电路中每流过1 mol电子,正极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如下图,则下列化学反应属于区域3的是

A.IBr + H2O == HIO + HBr
B.2NaHCO3![]() Na2CO3 + H2O + CO2↑
Na2CO3 + H2O + CO2↑
C.Fe3O4 + 4CO ![]() 3Fe + 4CO2
3Fe + 4CO2
D.Zn + H2SO4 == ZnSO4 + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物中,都有多个官能团:
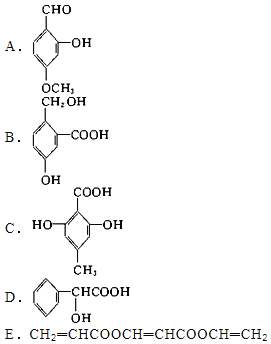
(1)可以看作醇类的是(填入编号,下同) ______。
(2)可以看作酚类的是 ______。
(3)可以看作羧酸类的是 ______。
(4)可以看作酯类的是 ______。
(5)可以看作醛类的是 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空:
(1)3.1g由13C和18O组成的一氧化碳分子,其中含中子_______mol,电子_______个。
(2)现有①4.5gHD ②标准状况下44.8L氩气 ③4℃时9mL水 ④质子数为5NA的甲烷。其中所含原子数最多的是____________(填编号)
(3)下列物质: ①CO2 ②熔融的NaCl ③H2SO4 ④液态氯化氢 ⑤BaSO4 ⑥氯水 ⑦葡萄糖 ⑧ Cu (填编号)
属于电解质的是_________________________;
属于非电解质的是________________________;
能导电的是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com