
���º����£���2 mol��A�����2 mol��B����ͨ�����Ϊ2 L���ܱ������з������·�Ӧ��2A(g)��B(g)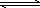 xC(g)��2D(s)��2 minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2 mol��B�������C��Ũ��Ϊ1.2 mol��L��1��
xC(g)��2D(s)��2 minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2 mol��B�������C��Ũ��Ϊ1.2 mol��L��1��
(1)x��________��
(2)����A�Ļ�ѧ��Ӧ����Ϊ________��A��ת������B��ת����֮��Ϊ________��
(3)�˷�Ӧ�ڸ��¶�ʱ�Ļ�ѧƽ�ⳣ��Ϊ________
(4)�����¶Ⱥ��ݻ����䣬��ƽ����ϵ���ٳ���2 mol��A��2 mol��B���壬�ﵽ��ƽ��ʱB�����ʵ���Ϊ________��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ �� | �й���Ϣ |
| A | ����������Ӧ��ˮ����ף���������̬�⻯��ң���Ӧ������ |
| B | �����������Ǵ�����������2�� |
| C | M������3������ |
| D | ������ԭ�Ӱ뾶��������Ԫ�� |
| E | �������������۴�����Ϊ6 |

 A2O4��g������H��0���ں��º��������£���һ����AO2��A2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ��
A2O4��g������H��0���ں��º��������£���һ����AO2��A2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)�˿��淴Ӧ��ƽ�ⳣ������ʽ�ɱ�ʾΪ_______���¶����ߺ�Kֵ��������ζ�Ÿ÷�Ӧ��������Ϊ_______(����ȡ����ȡ�)��Ӧ��
(2)���и�������£�ƽ�⽫�������ֱ仯��(�����������)
�ټ�������Na2SO4��10H2O���壬ƽ��_______�ƶ���
�ڼ����������ȵĽ�̿��ƽ��_______�ƶ���
(3)�����¶Ƚ���100 �棬���ڽ��¹����жԺ��ݷ�Ӧ����������ѹǿ����p(g)�����������ʵ�����n(H2)�������ݷ�Ӧ���������ƽ��Ħ��������![]() (g��mol-1)�������������������m(g)���ı仯��������ȷ��ͼ����_______��
(g��mol-1)�������������������m(g)���ı仯��������ȷ��ͼ����_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�����ʡ�Ƹ��и���3������������ۻ�ѧ�Ծ��������棩 ���ͣ������
��Ԫ������Ҫ�Ľ���Ԫ�أ��������ڹ�ҵ��������ʹ�õ���Ϊ�㷺�������кܶ���Ҫ�Ļ����P�仯ѧ��Ӧ��������ˮ��Ӧ��3Fe(s)��4H2O(g)��Fe3O4(s)��4H2(g) ��H
(1)������Ӧ��ƽ�ⳣ������ʽK��_______��
(2) ��֪����3Fe(s)��2O2(g)��Fe3O4(s) ��H1����1118.4kJ/mol
��2H2(g)��O2(g)��2H2O(g) ��H2����483.8kJ/mol
��2H2(g)��O2(g)��2H2O(l) ��H3����571.8kJ/mol
���H��_______��
(3)��t0Cʱ,�÷�Ӧ��ƽ�ⳣ��K��16����2L���º����ܱ�����������,�ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
|
|
Fe |
H2O��g�� |
Fe3O4 |
H2 |
|
��/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
��/mol |
1.0 |
1.5 |
1.0 |
1.0 |
�ټ�������H2O��ƽ��ת����Ϊ_______ (�������һλС��)��
������˵����ȷ����_______ (����)
A.������ѹǿ�㶨����Ӧ�ﵽƽ��״̬
B.�������������ܶȺ㶨����Ӧ�ﵽƽ��״̬
C.��������H2O��ƽ��ת���ʴ�����������H2O��ƽ��ת����
D.����Fe3O4�������H2O��ת����
(4)����(3)��װ�ø�Ϊ���ݾ���(������罻������)װ�ã����±�������ʼ���ʣ���ʼʱ��ƽ���ĸ����ʵ���������
|
|
Fe |
H2O��g�� |
Fe3O4 |
H2 |
|
��ʼ/mol |
3.0 |
4.0 |
0 |
0 |
|
ƽ��/mol |
m |
n |
p |
q |
���ڴ�ƽ����װ���м�������A��B��C����״���µĸ����ʣ�������
|
|
Fe |
H2O��g�� |
Fe3O4 |
H2 |
|
A/mol |
3.0 |
4.0 |
0 |
0 |
|
B/mol |
0 |
0 |
1 |
4 |
|
C/mol |
m |
n |
p |
q |
���������淴Ӧ��һ�δﵽƽ��״̬��,������װ����H2�İٷֺ������ɴ�С��˳�����еĹ�ϵ��
________(��A��B��C��ʾ����
(5)��֪Fe(OH)3��Ksp��2.79��10��39����FeCl3��Һ������ʾ��ǿ�����ԣ���ijFeCl3��Һ��pHΪ3,�����Һ��c(Fe3+)��________mol • L-1 (�������3λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ����������һ�и���12���¿���ѧ�Ծ� ���ͣ�ѡ����
�ں��º��ݵ��ܱ������У�������Ӧ ��ע��xΪP����ǰ��ϵ�����ٽ�3mol M��2
mol N��һ�������·�Ӧ����ƽ��ʱP���������Ϊa��������ʼʱM��N��PͶ������ʵ����ֱ�Ϊn��M����n��N����n��P����ƽ��ʱP���������ҲΪa��������˵����ȷ���� �� ��
��ע��xΪP����ǰ��ϵ�����ٽ�3mol M��2
mol N��һ�������·�Ӧ����ƽ��ʱP���������Ϊa��������ʼʱM��N��PͶ������ʵ����ֱ�Ϊn��M����n��N����n��P����ƽ��ʱP���������ҲΪa��������˵����ȷ���� �� ��
A�����ٴ�ƽ��ʱ�����������и�����l mol M��N��P����N��ת����һ������
B�������ƽ�����ټ���3mol M��2 mol N��P���������������a�����ж�x>4
C����x=2�������ϵ��ʼ���ʵ���Ӧ������3 n��N��=n��M��
D��������ϵ��ʼ���ʵ�������3 n��P��+8 n��M��=12 n��N�������ж�x=4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009-2010ѧ��������ѧ�߶���ѧ����ĩ���Ի�ѧ ���ͣ�ʵ����
��5�֣����ܱ�������Ͷ��һ������A��B������Ӧ��mA(g)+nB(g) 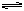 pC(g)��
pC(g)��
��1����ʹA��B��ת���ʵ���m��n ������ʼ����A��B�����ʵ���֮��Ϊ
��2������һ������A��B�����ڲ�ͬ������C�����������ʱ��ı仯��ͼ1��1��ʾ����
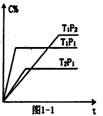
m+n p�����������������������
T1 T2�����������������������
�÷�Ӧ�ġ�H 0������������������������
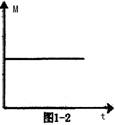
��3��һ�������£�������Ӧ��ʼ�ﵽ��ѧƽ������У���������ƽ����Է���������ʱ��ı仯��ͼ1��2��ʾ�����ں��º��ݵ������£���ԭƽ����ϵ����ͨ��һ������C������ϵ�������ƽ����Է��������� �����������С���������䡱����ȷ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com