

分析 (1)①中和滴定实验的玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶;
②上述滴定过程是盐酸滴定NaOH溶液,根据酸式滴定管的使用方法;
③根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断误差;
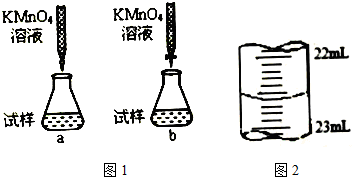
(2)①高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察;
②高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色;
③根据滴定管的精确度读数以及测量原理求出消耗标准溶液的体积.
解答 解:(1)①因中和滴定实验的玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶,故答案为:锥形瓶;
②酸式滴定管的使用方法左手控制旋塞,大拇指在管前,食指和中指在后,三指轻拿旋塞柄,手指略微弯曲,向内扣住旋塞,故选A;
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测得NaOH溶液浓度无影响;
故答案为:无影响;
(2)①高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应用酸式滴定管盛装,滴定时为便于观察颜色变化,滴定终点颜色由浅变深易于观察,应将高锰酸钾滴到待测液中,
故答案为:b;
②高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色,且半分钟内不褪色;
故答案为:溶液由无色变为浅紫色,且半分钟内不褪色;
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如上图为22.60ml,滴定管中的液面读数为22.60ml-0.50ml=22.10mL,
故答案为:22.10mL.
点评 本题考查了滴定操作,涉及中和反应和氧化还原反应,注意滴定管的结构、终点判断以及误差分析,题目难度中等.


科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:选择题
燃料电池具有能量转化率高无污染等特点,如图为Mg—NaClO燃料电池结构示意图。下列说法正确的是( )

A.镁作Y电极
B.电池工作时Na+向负极移动
C.废液的pH大于NaClO溶液的pH
D.X电极上发生的反应为:ClO-+2H2O-4e-=ClO3-+4H+
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2 粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH溶液体积(mL) | 待测盐酸的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
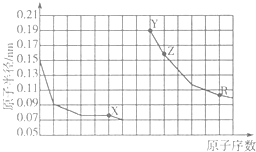
| A. | X、R的最简单氢化物的稳定性:X<R | |
| B. | X、Y、Z形成简单离子的半径大小:X>Y>Z | |
| C. | X、Y形成的化合物中只含有离子键 | |
| D. | Z单质着火可以用干冰进行灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g H218O中含有的中子数为NA | |
| B. | 1mol Fe与足量的浓硫酸反应,生成SO2的分子数为NA | |
| C. | 7.1g Cl2溶于水所得溶液中含有的Cl-数目为0.1NA | |
| D. | 丙烷燃料电池负极消耗2.24L(标准状况)气体时,电路中转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下水的离子积常数为Kw,在该温度下,a mol•L-1一元酸HA与b mol•L-1一元碱BOH等体积混合,溶液呈中性,则溶液中c(H+)=$\sqrt{Kw}$ | |
| B. | 已知MgCO3的Ksp=6.82×10-6mol2•L-2,则在含有固体MgCO3的Na2CO3溶液中,有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| C. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| D. | NH4Cl和NH3•H2O的混合溶液中,分别存在NH4+的水解平衡和NH3•H2O的电离平衡,二者对对方的平衡都起了促进作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com