
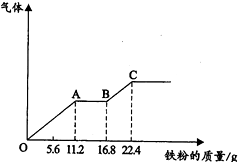
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.反应前后溶液体积不发生变化.
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.反应前后溶液体积不发生变化.分析 (1)由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑;
(2)OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
(3)消耗22.4g Fe时,此时溶液中溶质为FeSO4,根据铁元素质量守恒可知:n(H2SO4)=n(FeSO4)=n(Fe),进而计算硫酸的浓度.
解答 解:(1)由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O;Fe+Fe2(SO4)3═3FeSO4;Fe+2H+═H2↑+Fe2+;
(2)OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以每份中n(NO3-)=n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,故c(HNO3)=$\frac{0.2mol}{0.1L}$=2mol/L,
故答案为:2mol/L;
(3)消耗22.4g Fe时,此时溶液中溶质为FeSO4,根据铁元素质量守恒可知:n(H2SO4)=n(FeSO4)=n(Fe)=$\frac{22.4g}{56g/mol}$=0.4mol,故原混合物中H2SO4物质的量为:0.4mol×2=0.8mol,其浓度为:$\frac{0.8mol}{0.2L}$=4mol/L,
故答案为:4mol/L.
点评 本题以化学反应图象为载体,考查有关金属和酸反应的计算题,题目难度中等,关键根据图象分析各段发生的反应,注意明确与铁的反应中硝酸全部起氧化剂作用,熟练掌握守恒思想在化学计算中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 金属镁燃烧:化学能→热能和光能 | B. | 原电池:化学能→电能 | ||
| C. | 植物的光合作用:太阳能→热能 | D. | 太阳能热水器:光能→热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性(吸水溶液):HSCN>H2CO3>HCN | B. | 还原性(碱性溶液):Fe(OH)2>I->KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 氧化性(酸性溶液):I2>FeCl3>Co(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 144.0 g CuSO4 | B. | 144.0 g CuSO4•5H2O | ||
| C. | 225.0 g CuSO4•5H2O | D. | 250.0 g CuSO4•5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下,33.6L SO3中含有硫原子的数目为1.5NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目小于0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-8mol/L | B. | 1×10-6mol/L | C. | 2×10-8mol/L | D. | 1×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2s末A和B的转化率相同 | |
| B. | 2s末A的浓度为0.6mol/L | |
| C. | 反应速率$\frac{{v}_{(A)}}{{v}_{(B)}}$=$\frac{1}{2}$ | |
| D. | 用B表示的平均反应速率为0.3mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指单位时间内反应物浓度的减少或生成物浓度的增加 | |
| B. | 化学反应速率为“1.0mol/(L.s)”表示的意思是:时间为1s时,某物质的浓度为1.0mol/L | |
| C. | 化学反应速率也有大小也有方向 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)═H2O(l)△H=-44.0 kJ•mol-1 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+182.6 kJ•mol-1 | |
| C. | 形成化学键过程中放出862 kJ热量的化学反应 | |
| D. | 能量变化如图所示的化学反应.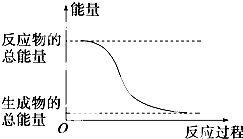 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com