
【题目】【化学——选修3物质结构与性质】
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等。运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是 (填元素符号),解释原因 。
(2)二甲基二硫和甲酸中,在水中溶解度较大的是 (填名称),原因 ;烧碱所属的晶体类型为 ;硫化碱(Na2S)的S2-的基态电子排布式是 。
(3)硝酸铵中,NO3-的立体构型为 ,中心原子的杂化轨道类型为 。
(4)1mol化合物NaCN中CN-所含的π键数为______,与CN-互为等电子体的分子有 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式 。
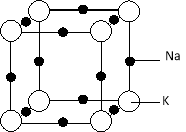
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为 ;晶胞中K 原子的配位数为 ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 (列出计算式,不需要计算出结果)。
【答案】
(1)N;同周期元素的第一电离能由左向右总体呈增大的趋势,同主族由上到下,元素的第一电离能逐渐减小,但N原子的2p能级为半充满的稳定结构,其第一电离能比O的大,故第一电离能最大的是N。
(2)甲酸;因为甲酸和水分子之间可以形成氢键,二甲基二硫和水分子之间只有范德华力。
离子晶体,[Ne]3p23p6
(3)平面正三角形,sp2杂化
(4)2NA,N2或CO,2NaCN+MnO2+2H2SO4(浓)=MnSO4+Na2SO4+(CN)2↑+2H2O
(5)Na3K(KNa3);6;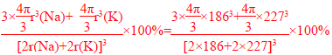
【解析】
试题分析:(1)同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素的,故NH4NO3、NaCN两种物质的元素中第一电离能最大的是N。
故答案为:N;同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于氧元素的;
(2)甲酸与水形成氢键,而二甲基二硫不能,故二甲基二硫和甲酸中溶解度较大的是甲酸,烧碱由钠离子和氢氧根构成,所以烧碱是离子晶体,S2-离子核外有18个电子,其基态电子排布式为1s2s22p63s23p6,
故答案为:甲酸;甲酸与水形成氢键;离子晶体;1s2s22p63s23p6;
(3)NO3-离子中氮原子的孤电子对数=![]() =0,价层电子对数=3+0=3,所以NO3-立体构型为平面三角形,中心原子氮原子的杂化轨道类型sp2。
=0,价层电子对数=3+0=3,所以NO3-立体构型为平面三角形,中心原子氮原子的杂化轨道类型sp2。
故答案为:平面三角形;sp2;
(4)原子序数相等、价电子总数也相等的微粒互为电子,CN-与N2互为等电子体,二者结构相似,CN-中含有C≡N三键,三键中含有1个σ键、2个π键数,所以1mol化合物NaCN中CN-所含的π键数为2NA,CN-中含有两个原子、10个价电子,与CN-互为等电子体的分子有CO、N2,
根据制取氯气的反应可知,氰化钠、二氧化锰和浓硫酸在加热条件下制得(CN)2,反应化学方程式为:2NaCN+MnO2+2H2SO4![]() (CN)2+Na2SO4+MnSO4+2H2O。
(CN)2+Na2SO4+MnSO4+2H2O。
故答案为:2NA;CO、N2;2NaCN+MnO2+2H2SO4![]() (CN)2+Na2SO4+MnSO4+2H2O;
(CN)2+Na2SO4+MnSO4+2H2O;
(5)晶胞中,钠原子数为12×1/4=3,钾原子数为8×1/8=1,所以合金的化学式为KNa3,
根据晶胞图可知,每个K 原子周围有6个钠原子,所以晶胞中K 原子的配位数为6,
晶胞中钠原子和钾原子体积之和为4/3π[(186pm)3×3+(227pm)3],晶胞的边长为钠原子和钾原子的直径之和为2×(186pm+227pm),所以晶胞的体积为(2×186pm+2×227pm)3,晶体的空间利用率为{![]() π[(186pm)3×3+(227pm)3]÷(2×186pm+2×227pm)3}×100%=
π[(186pm)3×3+(227pm)3]÷(2×186pm+2×227pm)3}×100%=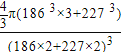 ×100%,
×100%,
故答案为:KNa3;6;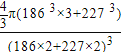 ×100%
×100%


科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使酸性KMnO4溶液褪色;
②苯中碳碳键的键长均相等;
③苯能在一定条件下跟H2加成生成环己烷;
④经实验测得邻二甲苯(![]() )仅一种结构;
)仅一种结构;
⑤苯在FeBr3存在的条件下同液溴可发生取代反应,但不能因化学变化而使溴水褪色。
A. ③④⑤ B. ①③④ . C. ①②④⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物种类繁多的原因叙述不正确的是
A.碳原子性质活泼,容易形成化合物
B.碳原子间能以共价键形成碳链或碳环
C.碳原子之间能形成单键,也能形成双键或叁键
D.碳原子除了彼此间可以成键外,还可以与其他元素的原子成键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 可以用溴水鉴别丙烯和苯
B. 用无水硫酸铜可以检验酒精中是否含有水
C. 可以用氢氧化钠溶液鉴别乙醇和乙酸
D. 可以用烧灼的方法鉴别真丝布料和纯棉布料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3的混合物中加入100mL 1molL﹣1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.3.2 g B. 2.4 g C.1.6 g D.0.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中,能大量共存的离子组是 :( )
A.Na、K+、SO42-、HCO3
B.Cu 2+、K+、SO42-、NO3-
C.NH4+、K+、Cl-、OH
D.Fe3+、K+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,HCN中C的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=_________,联氨和N2O4可作为火箭推进剂的主要原因为__________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨在水中第一步电离反应的平衡常数值为______________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 _。联氨可用于处理高压锅炉水中的氧气,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com