
 现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:
现用中和滴定法测定某烧碱溶液的浓度,有关数据记录如下:| 滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的液体 | ||
| 1 | 25.00 | 0.50 | 26.80 | 26.30 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |
| c(HCl)×V(HCl) |
| V(NaOH) |
| 26.30ml+26.34ml |
| 2 |
| c(HCl)×V(HCl) |
| V(NaOH) |
| 0.2500mol/L×0.02632L |
| 0.02500L |
| c(HCl)×V(HCl) |
| V(NaOH) |
 NH3?H2O+H+;氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+
NH3?H2O+H+;氯化铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,NH4++H2O?NH3.H2O+H+ NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);1×10-10mol/L;<.
NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);1×10-10mol/L;<.


科目:高中化学 来源: 题型:
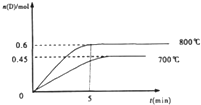 2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题:
2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.4gNH3中含N-H键数目为0.2NA |
| B、14 g乙烯和丙烯的混合物中总原子数为3NA |
| C、2.24LCO2与足量的Na2O2反应,反应中转移的电子总数为0.1NA |
| D、理论上氢氧燃料电池正极消耗11.2 L标准状况下气体时,外电路通过电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、85.5% |
| B、66.7% |
| C、33.3% |
| D、27.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
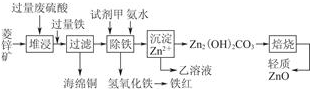
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.3 | 9.7 |
| Fe3+ | 1.5 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.下列有关仪器的使用,能实现的是
Ⅰ.下列有关仪器的使用,能实现的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L SO3中所含有的原子数2NA |
| B、实验室中用4mol HCl的浓盐酸跟足量MnO2 加热反应可制得的Cl2分子数为NA |
| C、25℃时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA |
| D、2.3g钠与一定量的氧气完全反应,转移的电子数一定为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com