
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:

(1)元素Z位于周期表中的位置_____________。
(2)在标准状况下,用充满X元素的氢化物气体及少量空气的混合气体的烧瓶做喷泉实验,实验结束后,则烧瓶中所得溶液的物质的量浓度为____________mol/L(结果保留两位有效数字)。
(3)W、Z的最高价氧化物对应的水化物的酸性大小顺序____________(用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为
_______________________________________。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为___________。
【答案】 第三周期 ⅥA族 0.045 HClO4>H2SO4 2Fe2+ +2Br-+ 2Cl2 =2Fe3+ + Br2 + 4Cl- S4N4
【解析】首先根据元素在周期表中的相对位置判断出元素的种类,然后结合元素周期律和单质及其化合物的性质分析解答。
由短周期元素在周期表中的相对位置,可知X、Y处于第二周期,Z、W处于第三周期,Z元素最外层电子数是其电子层数的2倍,最外层电子数为6,则Z为S元素,可推知W为Cl、Y为O、X为N,则(1)元素Z为S,在周期表中的位置是:第三周期第ⅥA族;(2)X元素的氢化物为氨气。由于氨气极易溶于水的,则充满氨气及少量空气的混合气体的烧瓶做喷泉实验,实验结束后,溶液的体积就是氨气的体积,则烧瓶中所得溶液的物质的量浓度为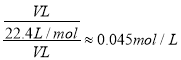 ;(3)非金属性Cl>S,故最高价氧化物对应的含氧酸的酸性:HClO4>H2SO4;(4)将氯气通入含等物质的量FeBr2的溶液中,氯气先氧化亚铁离子,再氧化溴离子,假设氯气、FeBr2均为1mol,根据电子转移守恒,则氧化1mol亚铁离子需要氯气为1mol÷2=0.5mol,剩余0.5mol氯气,根据电子转移守恒,0.5mol氯气可以氧化1mol溴离子,故反应的离子方程式为2Fe2+ +2Br-+ 2Cl2=2Fe3+ + Br2 + 4Cl- ;(5)S和N形成的一种化合物相对分子质量在170~190之间,且S的质量分数约为70%,则N元素质量分数为30%,则分子中S、N原子数目之比=70%/32:30%/14≈1:1,令分子式为(SN)n,则170<46n<190,可以确定3.7<n<4.13,故n=4,则分子式为:S4N4。
;(3)非金属性Cl>S,故最高价氧化物对应的含氧酸的酸性:HClO4>H2SO4;(4)将氯气通入含等物质的量FeBr2的溶液中,氯气先氧化亚铁离子,再氧化溴离子,假设氯气、FeBr2均为1mol,根据电子转移守恒,则氧化1mol亚铁离子需要氯气为1mol÷2=0.5mol,剩余0.5mol氯气,根据电子转移守恒,0.5mol氯气可以氧化1mol溴离子,故反应的离子方程式为2Fe2+ +2Br-+ 2Cl2=2Fe3+ + Br2 + 4Cl- ;(5)S和N形成的一种化合物相对分子质量在170~190之间,且S的质量分数约为70%,则N元素质量分数为30%,则分子中S、N原子数目之比=70%/32:30%/14≈1:1,令分子式为(SN)n,则170<46n<190,可以确定3.7<n<4.13,故n=4,则分子式为:S4N4。


科目:高中化学 来源: 题型:
【题目】电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M。下列有关分析或说法中正确的是( )
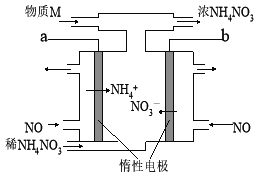
A.a应接直流电源的正极
B.阳极的电极反应式:NO+5e-+6H+=NH4++H2O
C.电路中通过5mol电子时,理论上最可处理22.4L标况下的NO
D.补充的物质M是NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.冰醋酸和乙酸乙酯的混合物可用乙醇萃取分离
B.直链烷烃分子中碳原子数越多其沸点越低
C.同分异构体的物理性质有一定差异,化学性质基本相同
D.由于碳碳双键不能旋转导致分子中的原子在空间的排列方式不同所产生的异构叫顺反异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关过滤和蒸发的操作中,正确的是( )
A. 过滤时,漏斗的下端管口紧靠烧杯内壁
B. 为了加快过滤速度,可用玻璃棒搅动过滤器中的液体
C. 实验完毕后,用手直接取走蒸发皿
D. 当蒸发皿中的固体完全蒸干后,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g) + B(g) ![]() 2C(g)。经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
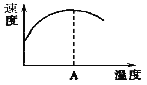
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
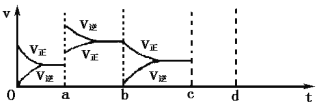
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,上图右表示酶参加的反应中温度与反应速率的关系,解释曲线变化原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
实验装置 |
|
|
|
|
实验现象 | a极质量减小, b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中充入2molA和1molB,发生反应2A(g)+B(g)![]() xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB、1.4molC为起始物质,达到平衡后,C的体积分数也为W%,则x值为( )
xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB、1.4molC为起始物质,达到平衡后,C的体积分数也为W%,则x值为( )
A.1 B.2 C.3 D.2或3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com