
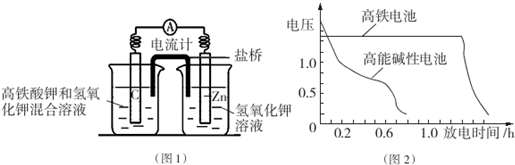
分析 Ⅰ.根据电池装置,Fe做负极放电,正极上高铁酸钾发生还原反应,均生成相同价态的化合物,高铁酸钾的氧化性很强,能够生成三价铁.
Ⅰ.(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3;根据电子转移计算Zn的质量;
(2)盐桥可起到平衡电荷,阴离子向负极移动,阳离子向正极移动;
(3)由图可知高铁电池的优点有:使用时间长、工作电压稳定;
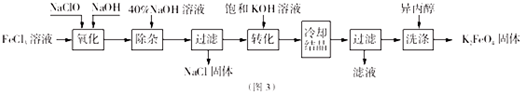
Ⅱ.氯化铁溶液中加入次氯酸钠和氢氧化钠,发生反应为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶、过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾.
(4)其中Fe元素化合价由+3价升高为+6价,共升高3价,Cl元素化合价由+1价降低为-1,价,共降低2价,化合价升降最小公倍数为6,则FeCl3的系数为2、NaClO的系数为3,再根据原子守恒配平;所含元素化合价降低的反应物是氧化剂;
(5)加入饱和KOH溶液可以增大K+的浓度,减小高铁酸钾的溶解,促进高铁酸钾晶体析出;
(6)根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38计算开始沉淀时c(OH-),再根据水的离子积计算溶液中c(H+),根据稀释定律计算需要盐酸的体积;
解答 解:Ⅰ.(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-,若维持电流强度为1A,电池工作十分钟,通过电子为$\frac{1A×600s}{96500C/mol}$,则理论消耗Zn为$\frac{1A×600s}{96500C/mol}$×$\frac{1}{2}$×65g/mol=0.2g,
故答案为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;02;
(2)盐桥中阴离子移向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷,构成闭合回路,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动,
故答案为:右;左;
(3)由图可知高铁电池的优点有:使用时间长、工作电压稳定,
故答案为:使用时间长、工作电压稳定;
Ⅱ.氯化铁溶液中加入次氯酸钠和氢氧化钠,发生反应为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶、过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾.
(4)其中Fe元素化合价由+3价升高为+6价,共升高3价,Cl元素化合价由+1价降低为-1,价,共降低2价,化合价升降最小公倍数为6,则FeCl3的系数为2、NaClO的系数为3,再根据原子守恒配平后反应方程式为:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,NaClO是氧化剂,
故答案为:2、10、3、2、9、5;NaClO;
所含元素化合价降低的反应物是氧化剂;
(5)加入饱和KOH溶液可以增大K+的浓度,减小高铁酸钾的溶解,促进高铁酸钾晶体析出,
故答案为:减小高铁酸钾的溶解,促进高铁酸钾晶体析出;
(6)溶液中c(Fe3+)=5mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,可知开始沉淀时c(OH-)=2×10-13mol/L,则溶液中c(H+)=$\frac{10{\;}^{-14}}{2×10{\;}^{-13}}$mol/L=0.05mol/L,根据稀释定律,需要盐酸的体积$\frac{0.05mol/L×100mL}{2mol/L}$=2.5mL,
故答案为:2.5.
点评 本题考查原电池工作原理、物质制备工艺流程,侧重考查物质制备方法的分析应用,掌握物质性质和平衡移动原理以及化学电池工作原理是解题关键,(1)中电极反应式书写为难点,题目应该给出一定的信息,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
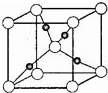 甲烷在一定条件下可生成以下微粒:
甲烷在一定条件下可生成以下微粒:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | p=$\frac{17V+22400}{22.422.4V}$ | B. | W=$\frac{17c}{ρ}$ | ||
| C. | $\frac{17V}{17V+22400}$=W | D. | C=$\frac{1000Vρ}{17V+22400}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com