
 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.
前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子.| 能级(I) | I1 | I2 | I3 | I4 | I5 |
| 电离能/kJ•mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析 前四周期元素A、B、C、D、E的原子序数依次增大,基态B原子核外电子占据3个能级且每个能级上电子数相等,则其原子核外电子排布式为1s22s22p2,故B为碳元素;基态A原子核外电子占据3个轨道,且原子序数小于碳,其原子核外电子排布式为1s22s22p1,故A为硼元素;C的双原子单质分子中σ键和π键数目之比为1:2,可推知C的单质为N2,C为N元素;基态E原子核外有6个未成对电子,外围电子排布式为3d54s1,故E为Cr元素;D的最高正化合价和最低负化合价之和等于4,处于VIA族,其原子序数小于Cr,故D为S元素.
(1)根据能量最低原理书写E原子核外电子排布式;D为S元素,原子核外电子排布式为1s22s22p63s23p4;
(2)处于稳定结构状态,不易失去电子;
(3)非金属性越强,最高价氧化物对应水化物的酸性越强(或者非羟基氧原子数目越多,酸性越强);
(4)计算中心原子的价层电子对数、孤对电子对数,确定杂化方式与空间构型;
(5)(DC)4为热色性固体,在较低温度下发生系列转化,应属于分子晶体;在常压下,(DC)4高于130℃分解为相应的单质,发生化学变化,破坏化学键;
对应ABn型分子,若中心原子最外层电子全部成键,则为非极性分子;NH3常与Cu2+、Zn2+、Ag+等形成配离子;
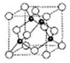
(6)①利用均摊法计算晶胞中各原子数目,进而确定该晶体的化学式;
②A、C连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$.根据晶胞中原子数目计算晶胞质量,结合密度计算晶胞体积,进而计算晶胞棱长,可得晶胞体对角线长度.
解答 解:前四周期元素A、B、C、D、E的原子序数依次增大,基态B原子核外电子占据3个能级且每个能级上电子数相等,则其原子核外电子排布式为1s22s22p2,故B为碳元素;基态A原子核外电子占据3个轨道,且原子序数小于碳,其原子核外电子排布式为1s22s22p1,故A为硼元素;C的双原子单质分子中σ键和π键数目之比为1:2,可推知C的单质为N2,C为N元素;基态E原子核外有6个未成对电子,外围电子排布式为3d54s1,故E为Cr元素;D的最高正化合价和最低负化合价之和等于4,处于VIA族,其原子序数小于Cr,故D为S元素.
(1)E为前四周期中元素,且基态E原子核外有6个未成对电子,则其原子核外电子排布式为1s22s22p63s23p63d54s1;D为S元素,原子核外电子排布式为1s22s22p63s23p4,核外电子占据的能量最高的能级符号为3p,
故答案为:1s22s22p63s23p63d54s1;3p;
(2)硼原子失去第3个电子后,达到稳定结构,不易再失去电子,故I3和I4之间差异最大,
故答案为:硼原子失去第3个电子后,达到稳定结构,不易再失去电子;
(3)B、C、N的非金属性依次增强,故H3BO3、H2CO3、HNO3的酸性依次增强(或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2,故H3BO3、H2CO3、HNO3的酸性依次增强),
故答案为:B、C、N的非金属性依次增强或H3BO3、H2CO3、HNO3的非羟基氧原子个数依次为0、1、2;
(4)BCl3中B原子孤对电子对数为$\frac{1}{2}$×(3-1×3)=0,价层电子对数为3+0=3,采用sp2杂化、立体构型为平面正三角形,
CCl4中C原子孤对电子对数为$\frac{1}{2}$×(4-1×4)=0,价层电子对数为4+0=4,采用sp3杂化、立体构型为正四面体,
NCl3中N原子孤对电子对数为$\frac{1}{2}$×(5-1×3)=1,价层电子对数为3+1=4,采用sp3杂化、立体构型为三角锥形,
故答案为:NC13;
(5)(SN)4为热色性固体,在较低温度下发生淡黄色→橙黄色→深红色的转化,应属于分子晶体,破坏的作用力是分子间作用力.在常压下,(SN)4高于130℃分解为相应的单质,发生化学变化,破坏共价键;
在B、C、D的简单气态氢化物分别为CH4、NH3、H2S,其中CH4中碳原子最外层4个电子全部参与
中,属于非极性分子,常与Cu2+、Zn2+、Ag+等形成配离子的是NH3,
故答案为:分子间作用力;共价键;CH4;NH3;
(6)①晶胞中黑色球处于晶胞内部,晶胞中黑色球数目为4,白色球处于晶胞丁点与面心,晶胞中白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故白色球与黑色球数目之比为1:1,可确定该晶体的化学式为BN,
故答案为:BN;
②晶胞质量为(4×$\frac{11}{{N}_{A}}$+4×$\frac{14}{{N}_{A}}$)g=$\frac{100}{{N}_{A}}$g,则晶胞棱长=$\root{3}{\frac{\frac{100}{{N}_{A}}g}{ρg•c{m}^{3}}}$=$\root{3}{\frac{100}{ρ{N}_{A}}}$cm=$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 pm,A、C连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,故A与C形成共价键的键长d=$\frac{1}{4}$×$\sqrt{3}$×$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 pm=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 pm,
故答案为:$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{100}{ρ{N}_{A}}}$×1010 .
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化轨道、空间构型、配合物、晶胞结构与计算等,(6)中键长计算为易错点、难点,需要熟记常见晶胞结构,对学生的空间想象与数学计算有一定的要求,掌握均摊法进行晶胞有关计算.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
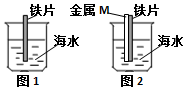
| A. | 图1铁片靠近烧杯底部的部分,腐蚀更严重 | |
| B. | 若M是锌片,可保护铁 | |
| C. | 若M是铜片,可保护铁 | |
| D. | M是铜或是锌都不能保护铁,是因没有构成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和④ | B. | ①和③ | C. | ②和③ | D. | ②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
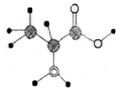 如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )
如图是某有机分子的球棍模型图,图中大、小“球”表示不同的原子,“棍”表示化学键.有关该有机物说法错误的是( )| A. | 分子式为C3H7O2N | |
| B. | 该分子不能与碳酸钠发生反应 | |
| C. | 该分子可以与盐酸发生反应 | |
| D. | 该分子在一定条件下可以反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
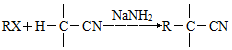
 .
.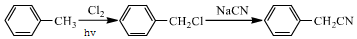 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
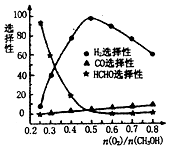 碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15NA | |
| B. | 0.1 mol•L-1(NH4)2SO4溶液与0.2 mol•L-1NH4CI溶液中的NH4+数目相同 | |
| C. | H2和CO混合气体8.96 L在足量O2中充分燃烧消耗O2分子数为0.2 NA | |
| D. | 含0.1molNH4HSO4的溶液中,阳离子数目略大于0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com