
分析 (1)0.1mol/L NaOH溶液与0.06mol/L的H2SO4溶液等体积混合(忽略混合后体积的变化)后氢离子剩余,计算氢离子浓度以及溶液的pH;
(2)①根据水的离子积Kw=c(H+)•c(OH-)来计算;
②将pH=2的盐酸和pH=11的氢氧化钠溶液混合后混合溶液的pH=10,判断剩余的物质,根据反应情况计算需要的酸的体积.
解答 解:(1)0.1mol/L NaOH溶液与0.06mol/L的H2SO4溶液等体积混合(忽略混合后体积的变化)后氢离子剩余,剩余氢离子的浓度c=$\frac{0.06×2-0.1}{2}$mol/L=0.01mol/L,所以pH=-lgc(H+)=2,故答案为:2;
(2)①测得0.01mol•L-1 的NaOH溶液的pH=10,所以Kw=c(H+)•c(OH-)=10-10×0.01=1.0×10-12,答:该温度下水的Kw是1.0×10-12;
②设:需Vml盐酸与10ml氢氧化钠溶液混合,pH=2的盐酸和pH=11的氢氧化钠溶液混合(忽略混合后体积的变化),混合溶液的pH=10,显示碱性,则$\frac{0.01×0.01-0.01×0.001}{0.001(V+10)}$=0.01,解得V=45mL,答:需45ml盐酸与10ml氢氧化钠溶液混合.
点评 本题考查酸碱混合溶液定性判断知识点,正确理解混合溶液pH计算等即可解答,会正确计算酸溶液中水电离出c(H+),为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 可以用湿润的蓝色石蕊试纸检验Cl2中的HCl | |
| B. | 可以用湿润的有色布条检验Cl2中的HCl | |
| C. | 可以用饱和NaCl溶液除去Cl2中的HCl | |
| D. | 可以用饱和NaOH溶液除去Cl2中的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O原子只存在氧气中 | |
| B. | 18O原子只存在三氧化硫中 | |
| C. | 18O一定不存在二氧化硫中 | |
| D. | 氧气中,二氧化硫中,三氧化硫中都可能存在18O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲中的每个小黑点表示1个电子 | |
| B. | 图乙表示1s电子只能在球体内出现 | |
| C. | 图乙表明1s轨道呈球形,有无数对称轴 | |
| D. | 不同能层的s轨道平均半径都一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | H2与Cl2的燃烧反应 | ||
| C. | 铝与稀盐酸反应 | D. | 灼热的碳与CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图所示的反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
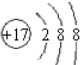 ;
;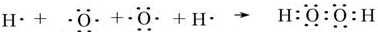 ;
;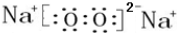 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,lmolH发生该反应转移电子数为6.02×1023或NA;
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,lmolH发生该反应转移电子数为6.02×1023或NA;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.01mol | C. | 6.5g | D. | 5.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com