
目前人们正在研究开发一种高能电池——钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β″-Al2O3陶瓷作固体电解质,反应式为2Na+xS![]() Na2Sx。以下说法正确的是( )
Na2Sx。以下说法正确的是( )
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生还原反应
C.充电时,钠极与外接电源正极相连,硫极与外电源的负极相连
D.充电时阳极发生的反应:SX2--2e-![]() Xs
Xs
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
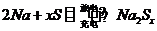
查看答案和解析>>
科目:高中化学 来源: 题型:
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生还原反应
C.充电时,钠极与外接电源正极相连,硫极与外电源的负极相连
D.充电时阳极发生的反应:![]() -2e-
-2e-![]() xS
xS
查看答案和解析>>
科目:高中化学 来源: 题型:
2Na+xS![]() Na2Sx
Na2Sx
以下说法,正确的是( )
A.放电时,钠作正极、硫作负极
B.放电时,钠极发生还原反应
C.充电时,钠极与外接电源正极相连,硫极与外接电源负极相连
D.充电时,阳极发生的反应是:![]()
![]() xS+2e-
xS+2e-
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。A元素的一种核素质子数与质量数在数值上相等;B、E同主族,且核电荷数之比为1︰2;C的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;D的最外层电子数是内层电子总数的一半。试回答下列问题:
(1)F位于周期表中第________周期________族。
(2)常温时,39 g B、C按原子个数比1︰l形成的化合物X与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 ;
写出少量X与FeCl2溶液反应的离子方程式_______________________________________。
(3)B、C、F组成的化合物Y是家用消毒剂的主要成分,Y的溶液呈碱性,用离子方程式解释其原因______________________________;起消毒作用的微粒电子式为_________。
(4)四原子分子Z与C的单质和水反应所得的阴离子电子数相等,Z的分子空间构型为___________型,它属于_________分子(填“极性”或“非极性”);请比较Z与DA3的沸点高低并加以解释_____________________________________________________。
(5)目前人们正在研究开发一种高能电池,它是以熔融的C、E单质为两极,以C离
子导电的β-Al2O3陶瓷作固体电解质,反应式为:2C+xE ![]() C2Ex 。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质 。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
C2Ex 。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质 。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
查看答案和解析>>
科目:高中化学 来源:2011届四川省成都七中高三上学期“一诊”模拟(理综)化学部分 题型:填空题
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。A元素的一种核素质子数与质量数在数值上相等;B、E同主族,且核电荷数之比为1︰2;C的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;D的最外层电子数是内层电子总数的一半。试回答下列问题:
(1)F位于周期表中第________周期________族。
(2)常温时,39 g B、C按原子个数比1︰l形成的化合物X与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式 ;
写出少量X与FeCl2溶液反应的离子方程式_______________________________________。
(3)B、C、F组成的化合物Y是家用消毒剂的主要成分,Y的溶液呈碱性,用离子方程式解释其原因______________________________;起消毒作用的微粒电子式为_________。
(4)四原子分子Z与C的单质和水反应所得的阴离子电子数相等,Z的分子空间构型为___________型,它属于_________分子(填“极性”或“非极性”);请比较Z与DA3的沸点高低并加以解释_____________________________________________________。
(5)目前人们正在研究开发一种高能电池,它是以熔融的C、E单质为两极,以C离
子导电的β-Al2O3陶瓷作固体电解质,反应式为:2C+xE  C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com