
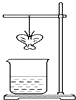
 某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )
某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 酚酞 | 酚酞 | 石蕊 | 石蕊 |
| 小烧杯中的溶液 | 浓氨水 | 浓NaOH | 浓盐酸 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Z>X>Y | B. | X>Y>Z | C. | Y>X>Z | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可以用来区别胶体和溶液 | |
| B. | 水银、水玻璃、胆矾都是纯净物 | |
| C. | HCl、NH3、BaSO4都是电解质 | |
| D. | H2、D2、T2属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
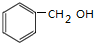
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com