
| A、不需要加热就能发生的发应一定是放热反应 |
| B、吸热反应在常温下可能发生 |
| C、反应吸热还是放热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、物质发生化学变化一定伴随着能量变化 |


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
| A、HClO3 |
| B、H2SeO3 |
| C、H2BO2 |
| D、HMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠与盐酸;氢氧化钠与醋酸 |
| B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液 |
| C、Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液 |
| D、石灰石与硝酸;碳酸钙与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| A、在①、②中分别加入氯化铵固体,两溶液的 pH均增大 |
| B、分别将等体积的①和②加水稀释m倍和n倍后,pH仍相同,则:m>n |
| C、把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、将溶液②和溶液③等体积混合,混合后所得溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
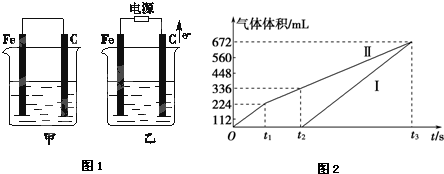
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6的溶液一定呈酸性 |
| B、25℃时,pH=7的一定是纯水 |
| C、溶于水呈中性的盐一定未发生水解 |
| D、酸碱恰好中和时,溶液不一定为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Sb元素的质量数是121.8 |
| B、Sb元素的相对原子质量是122 |
| C、Sb原子5p亚层有3个未成对电子 |
| D、Sb原子最外层有5个能量相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
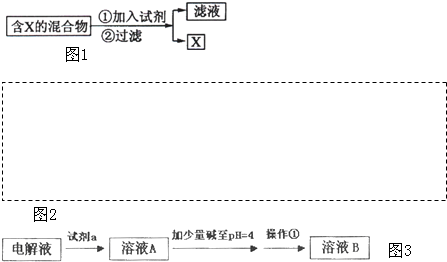
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀 | 3.9. | 9.7 | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
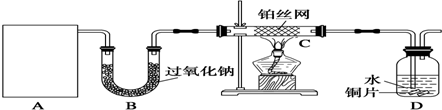

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com