
饱和石灰水中存在溶解平衡:Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),现向其中加入少量生石灰,充分反应后恢复至原温度。则下列说法中不正确的是
Ca2+(aq)+2OH-(aq),现向其中加入少量生石灰,充分反应后恢复至原温度。则下列说法中不正确的是
A.容器中固体的质量增加 B.溶液中Ca2+的浓度减小
C.溶液中OH-的数目减少 D.溶液的pH不变
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
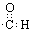 A.-CHO的电子式:
A.-CHO的电子式:
B.丙烷分子的比例模型为: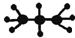
C.顺-1,2-二溴乙烯结构式为: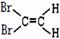
D.1,4-二甲苯的结构简式为: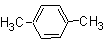
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
A.若A为盐酸,B为MnO2,C中盛有品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛有澄清石灰水,则C中溶液出现浑浊
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中先产生白色沉淀后沉淀溶解
D.上述实验中仪器D都可以用长玻璃导管代替
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各说法中,正确的是
A.热化学方程式中的化学计量数表示物质的量,可以是分数
B.△H>0表示放热反应,△H<0表示吸热反应
C.酸碱中和时放出的热叫做中和热
D.1mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH < 7,则下列有关此溶液叙
述不正确的是
A.溶液中由水电离产生的H+浓度小于1×10-7 mol/L
B.溶液中CH3COOH的电离程度大于CH3COONa的水解程度
C.c(CH3COO¯ ) + c(CH3COOH)-c(Na+) = 0.1 mol/L
D.溶液中离子浓度的大小关系为:c(CH3COO¯)>c(Na+)>c(H+)>c(OH¯)
查看答案和解析>>
科目:高中化学 来源: 题型:
|
|
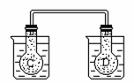 如右图所示,在常温下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有 500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向 A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶
如右图所示,在常温下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有 500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向 A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶 解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和 D 中气体的颜色变化是____ __ 。
① 不变 ② 烧瓶 C 中颜色变深,D 中变浅
③ 烧瓶 D 中 变深, C 中变浅 ④ 两个烧瓶中的颜色都变深
查看答案和解析>>
科目:高中化学 来源: 题型:
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。
[方案一]
[实验方案] 将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_______________________________。
[实验步骤]
(1)称取10.8 g铝镁合金粉末样品,溶于体积为V、物质的量浓度为4.0 mol·L-1的NaOH溶液中,充分反应。则NaOH溶液的体积V≥__________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将______________(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案] 将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
[实验步骤]
(1)同学们拟选用下列实验装置完成实验:
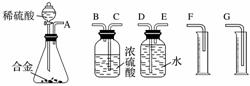
你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。

(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管a的作用是_____________________________________;
②实验前后量气管中液面读数分别为V1 mL、V2 mL,则产生氢气的体积为__________mL;
③若需确定产生氢气的量,还需测定的数据是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
)四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据的是 (填序号)。
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:______________________,
原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,2.24 L水中所含电子总数为NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO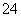 数目为0.6NA
数目为0.6NA
C.1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA
D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com