
YBa2Cu8Ox(Y为元素钇)是一种重要超导材料,下列关于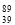 Y的说法错误的是
Y的说法错误的是
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数是39
D.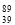 Y 和
Y 和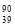 Y 是两种不同的核素
Y 是两种不同的核素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年广东省等七校高三12月联考理综化学试卷(解析版) 题型:选择题
下列实验装置设计正确、且能达到目的的是
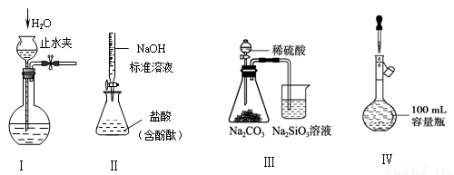
A.实验I:检查装置的气密性
B.实验II:测定未知盐酸的浓度
C.实验III:比较硫、碳、硅三种元素的非金属性强弱
D.实验IV:定容
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:填空题
(11分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I—氧化为I2:S2O82—+2I—=2SO42—+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程: 、 (不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质中,其水溶液能导电,溶于水时化学键被破坏,且该物质属于非电解质的是
A.Cl2 B.SO2 C.NaOH D.C2H5OH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(8分)化学是一门以实验为基础的学科。
(1)下列描述正确的是_____________(填写序号)。
A.金属钠通常保存在煤油中,防止接触空气而变质
B.容量瓶、分液漏斗在使用时需要检验是否漏水
C.海带提取碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸发皿、泥三角、三脚架、酒精灯
D.向含有Fe2+的FeCl3溶液中通入Cl2或滴加H2O2均可以除去Fe2+
E.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入BaCl2溶液,产生白色沉淀,滴加稀硝酸,观察白色沉淀是否溶解
(2)实验室中常用下图仪器制取、净化和收集气体。

①关闭A装置中的止水夹,向分液漏斗中加入适量水,打开活塞,说明A装置气密性良好的现象是_______________________________________。
②实验室可利用A装置在加热条件下制取Cl2,写出该反应的离子方程式__________。
③若用B装置除去SO2中混有的HCl气体,B中盛放试剂的名称为_______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.向CuCl2溶液中加入少量氨水:Cu2++2OH一=Cu(OH)2↓
B.向海带灰的浸出液中(酸性)加入双氧水制取I2:2I一+H2O2+2H+=I2+2H2O
C.足量稀硫酸与氢氧化钡溶液混合:Ba2++OH一+SO +H+=BaSO4↓+H2O
+H+=BaSO4↓+H2O
D.铝溶于氢氧化钠溶液:2Al+2OH一+3H2O=2[Al(OH)4]一+3H2 ↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产硫酸亚铁溶液,进而可制备绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)等重要试剂。生产硫酸亚铁溶液的工艺流程如下:
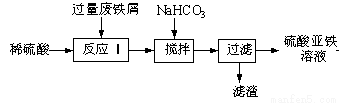
回答下列问题:
(1)加入少量NaHCO3,调节溶液pH的目的是__________________________。
(2)硫酸亚铁溶液在空气中久置容易变质,用离子方程式表示其变质的原因:_____。
(3)若向所得FeSO4溶液中加入少量3 moL? L-1 H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)。硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.352g Cu2S和CuS的混合物在酸性溶液中用40.00 mL0.150 mol?L-1 KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,剩余的KMnO4恰好与50.00mL 0.200 mol?L-1 (NH4)2Fe(SO4)2溶液完全反应。
①配平离子方程式: MnO4-+ Fe2++ H+—— Mn2++ Fe3++ H2O
②Cu2S和CuS的混合物在酸性溶液中用0.150 mol?L-1 KMnO4溶液处理后,溶液需煮沸的原因是:_______________________________________________。
③实验室配制500mL 3 moL? L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g? mL-1硫酸的体积为__________ mL。(保留1位小数)
④试计算混合物中CuS的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列有关物质的性质、制取或应用等的说法中正确的是
A.用10%的盐酸蒸发浓缩获得30%的盐酸
B.水晶项链和餐桌上的瓷盘都是硅酸盐制品
C.可利用丁达尔效应来区别淀粉溶液和氯化钠溶液
D.二氧化硫具有漂白性,与氯水混合使用效果更好
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
下列装置用于实验室以硫酸铝制取一定量Al2O3,能达到实验目的的是
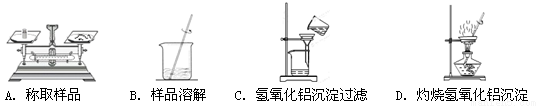
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com