
【题目】Ⅰ.甲硅烷(SiH4)常温下是一种无色气体,遇空气发生自燃。
(1)甲硅烷中含有的化学键是___,其在固态时属于___晶体。
(2)室温下1g甲硅烷燃烧生成SiO2和H2O放热44.6kJ,其热化学方程式为___。
Ⅱ.①CaCO3(s)=CaO(s)+CO2(g) △H=178.2kJmol-1
②2Na(s)+Cl2(g)=2NaCl(s) △H=-822.0kJmol-1
则:
(3)上述反应①②中属于放热反应的是___(填序号)。
(4)根据②计算生成1molNaCl(s)时,△H=___kJmol-1
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图。该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
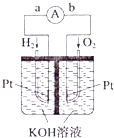
(5)氢氧燃料电池的能量转化形式主要是___。在导线中电子流动方向为___(用a、b表示)。
(6)负极反应式为___。
(7)金属锂是一种重要的储氢材料,吸氢和放氢原理如下:2Li+H2=2LiH,LiH+H2O=LiOH+H2↑,则2mol锂储氢后释放出的H2可以消耗标准状态O2的体积是___L。
【答案】共价键 分子 SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1427.2kJ/mol ② -411.0kJ·mol-1 化学能转化为电能 a→b 2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O 22.4
【解析】
Ⅰ、![]() 由非金属形成的化合物,非金属元素之间的化学键为共价键,
由非金属形成的化合物,非金属元素之间的化学键为共价键,![]() 在常温下为气体,沸点较低,应为分子晶体。答案为:共价键;分子;
在常温下为气体,沸点较低,应为分子晶体。答案为:共价键;分子;
![]() 甲硅烷的物质的量为
甲硅烷的物质的量为![]() ,放出
,放出![]() 的热量,则1mol甲硅烷完全燃烧放出的热量为
的热量,则1mol甲硅烷完全燃烧放出的热量为![]() ,热化学方程式为
,热化学方程式为![]()
![]() 。
。
Ⅱ、![]() 据热化学方程式,
据热化学方程式,![]()
![]() 可知
可知![]() 为吸热反应,
为吸热反应,![]() 为放热反应。答案为:
为放热反应。答案为:![]() ;
;
![]() 生成2molNaCl放出
生成2molNaCl放出![]() 热量,则生成1molNaCl放出其一半的热量,为411kJ热量。答案为:-411.0kJ·mol-1;
热量,则生成1molNaCl放出其一半的热量,为411kJ热量。答案为:-411.0kJ·mol-1;
Ⅲ、![]() 该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是由a到b。答案为:化学能转化为电能;
该装置是把化学物质中的能量转化为电能,所以是化学能转变为电能;在原电池中,负极上失电子,正极上得电子,电子的流向是从负极流向正极,所以是由a到b。答案为:化学能转化为电能;![]() ;
;
![]() 该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为
该反应中负极上氢气失电子生成氢离子而被氧化,所以电极反应式为![]() 或
或![]() 。
。
![]() 据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,2mol氢气能够消耗1mol氧气,1mol氧气在标准状况下体积为
据吸氢和放氢原理可知,2mol锂储氢后生成2molLiH,释放2mol氢气,2mol氢气能够消耗1mol氧气,1mol氧气在标准状况下体积为![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法正确的是
A. 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3·H2O)
B. 用少量水稀释0.1mol·L-1氨水时;溶液中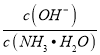 减小
减小
C. 将Na2CO3溶液从20℃升温至30℃,溶液中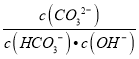 增大
增大
D. pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.NH4Cl晶体中只有离子键
B.液态HI受热分解的过程中,只破坏分子间作用力
C.Si3N4和CCl4均属于原子晶体
D.C4H10的2种同分异构体因为分子间作用力大小不同,因而沸点不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() +I2+H2O=
+I2+H2O=![]() +2I-+2H+,某无色溶液中可能含有Fe3+、Na+、K+、Cu2+、H+、
+2I-+2H+,某无色溶液中可能含有Fe3+、Na+、K+、Cu2+、H+、![]() 、I-、
、I-、![]() 、
、![]() 中的几种,且所有离子物质的量浓度相等。向溶液中逐滴加入H2O2溶液,刚开始一段时间溶液颜色没有变化,之后变黄色(不考虑盐类水解及水的电离);向反应后的溶液中滴加BaCl2溶液,产生白色沉淀。下列关于该溶液的判断正确的是
中的几种,且所有离子物质的量浓度相等。向溶液中逐滴加入H2O2溶液,刚开始一段时间溶液颜色没有变化,之后变黄色(不考虑盐类水解及水的电离);向反应后的溶液中滴加BaCl2溶液,产生白色沉淀。下列关于该溶液的判断正确的是
A.不可能含有Cu2+、Fe3+,可能有H+
B.肯定有![]()
C.肯定含有Na+、K+、![]()
D.可能含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某黄色矿物中主要成分X仅含三种元素,不含结晶水,某研究小组为了探究X的组成和性质,设计并完成了如下实验:
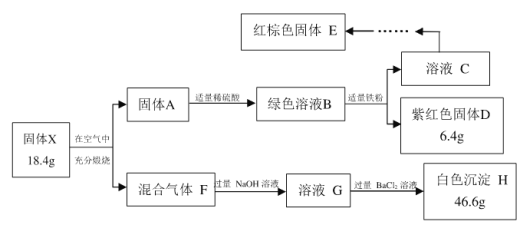
注:适量代表该试剂恰好完全反应
(1)固体X中所含元素有Fe、S和___________,其化学式为___________;
(2)F→G的总离子方程式(只写一步)是_____________________________________,该反应的还原剂是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
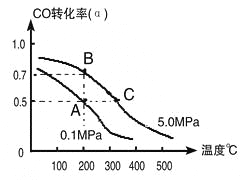
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=_______;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA____tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:_______________。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
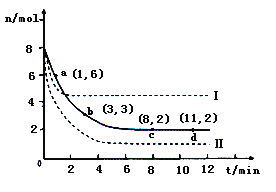
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线_______。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_______。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
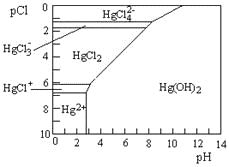
①下列说法中正确的是_____。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ)=10ˉ1mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl++C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是_____(填晶体类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
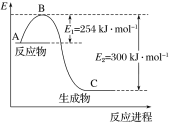
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是

A.b、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+) =c(OH-) +c(CH3COOH)
D.用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积 Vb = Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com