
| 化学式 | 开始沉 淀时的 pH值 | 沉淀完 全时的 pH值 |
| Mn(OH)2 | 8.8 | 10.4 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe (OH)3 | 2.7 | 3.7 |
| Zn(OH)2 | 6.4 | 7.8 |

| ||


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
| 氧气 |
| 点燃 |
| 氧气 |
| 点燃 |
| 稀硫酸 |
| Mg |
| 点燃 |
| NH3、CO2 |
| △ |
| 氯气 |
| 点燃 |
| 氯气 |
| 点燃 |
| A、①④ | B、②③ | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
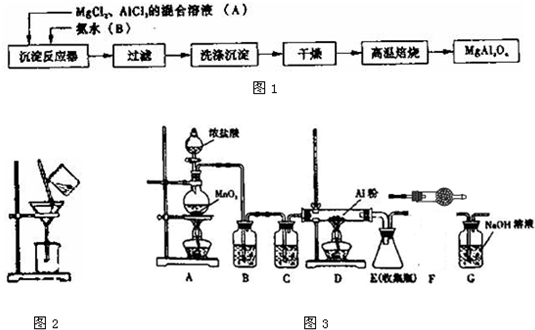
查看答案和解析>>
科目:高中化学 来源: 题型:
 加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)
加入0.1mol MnO2粉末于50mL过氧化氢溶液(ρ=1.1g?mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.(忽略溶液体积变化)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用澄清石灰水鉴别CO2和SO2 |
| B、用丁达尔效应鉴别淀粉溶液和氢氧化铝胶体 |
| C、用焰色反应鉴别KCl和NaNO3 |
| D、用NaOH溶液鉴别FeCl3溶液和Fe(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的转化率变大 |
| B、平衡向正反应方向移动 |
| C、D的质量分数变大 |
| D、a<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、3 | C、4 | D、5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com