
 碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:
碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:分析 (1)根据化学键断裂形成原子需要吸收能量,原子之间形成化学键放出能量;
(2)根据放热过程生成物的总能量小于反应物总能量,吸热过程生成物的总能量高于反应物总能量,结合炭和水蒸汽发生反应生成CO、H2为放热反应判断;
(3)反应物为C和H2O,生成物为CO、H2,依据原子个数守恒、得失电子守恒写成反应的方程式.
解答 解:(1)化学键断裂形成原子需要吸收能量,原子之间形成化学键放出能量,步骤①为断键过程需要吸收能量,步骤②为成键过程需要放出能量;
故答案为:吸热;放热;
(2)步骤1为吸热过程,故E2>E1,步骤2是放热过程,故E2>E3,由于炭和水蒸汽发生反应生成CO、H2为吸热反应,故E1>E3,故E2>E1>E3,
故答案为:E2>E1>E3;
(3)C和H2O发生氧化还原生成CO、H2,化学方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
点评 本题考查了化学反应能量变化的原因,明确化学反应的实质是解题关键,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
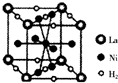 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. ④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.
④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4的摩尔质量是56 g | |
| B. | N4与N2互为同位素 | |
| C. | 相同质量的N4和N2含原子个数比为1:2 | |
| D. | N4与N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
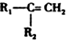 $\stackrel{HBr/过氧化物}{→}$
$\stackrel{HBr/过氧化物}{→}$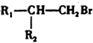 ②
②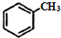 $\stackrel{KMnO/H-}{→}$
$\stackrel{KMnO/H-}{→}$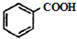
 ;反应类型:取代反应;
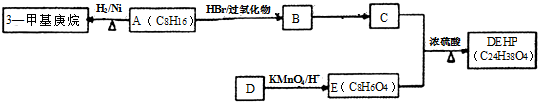
;反应类型:取代反应;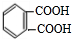 ;DEHP的结构简式是
;DEHP的结构简式是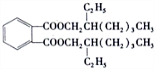 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
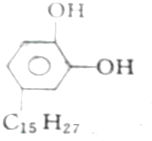
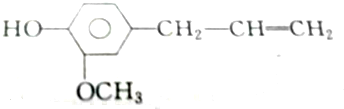
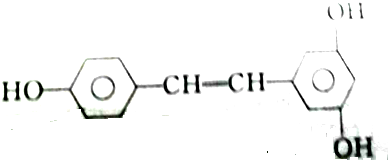
| A. | 2mol、2mol、6mol | B. | 5mol、2mol、6mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+H→H-H | B. | H-Cl→H+Cl | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2NaOH=Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
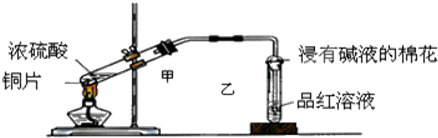
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  铁丝的析氢腐蚀实验 | B. | 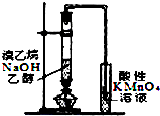 检验该反应的有机产物 | ||
| C. | 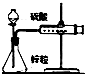 结合秒表测量锌与硫酸的反应速率 | D. | 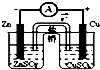 验证化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com