
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
分析 周期元素W、X、Y和Z的原子序数依次增大,元素Y是地壳中含量最丰富的金属元素,则Y是Al元素,
X原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8个,所以X为C元素;
元素W是制备一种高效电池的重要材料,且原子序数小于C,为Li元素;
Z原子的最外层电子数是其电子层数的2倍,且原子序数大于Al,为S元素;
A.元素S可与元素C形成化合物CS2,只含共价键的化合物属于共价化合物;
B.元素C与氢形成的原子比为1:1的化合物有烃类化合物多种;
C.元素Al的单质强酸、强碱溶液反应生成氢气;
D.元素Li、S的氯化物分别为LiCl和CCl4,则Li+的最外层只有两个电子.
解答 解:周期元素W、X、Y和Z的原子序数依次增大,元素Y是地壳中含量最丰富的金属元素,则Y是Al元素,
X原子的最外层电子数是内层电子数的2倍,最外层电子数不超过8个,所以X为C元素;
元素W是制备一种高效电池的重要材料,且原子序数小于C,为Li元素;
Z原子的最外层电子数是其电子层数的2倍,且原子序数大于Al,为S元素;
A.元素S可与元素C形成化合物CS2,只含共价键的化合物属于共价化合物,二硫化碳中只含共价键,属于共价化合物,故A正确;
B.元素C与氢形成的原子比为1:1的化合物有烃类化合物多种,如乙炔、苯等,故B正确;
C.元素Al的单质强酸、强碱溶液反应生成氢气,盐酸是强酸、氢氧化钠是强碱,所以Al和盐酸、氢氧化钠都反应生成氢气,故C正确;
D.元素Li、S的氯化物分别为LiCl和CCl4,则Li+的最外层只有两个电子,不满足8电子稳定结构,故D错误;
故选D.
点评 本题考查原子结构和元素性质,侧重考查元素化合物知识、物质结构和性质,正确推断元素是解本题关键,知道8电子稳定结构的判断方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
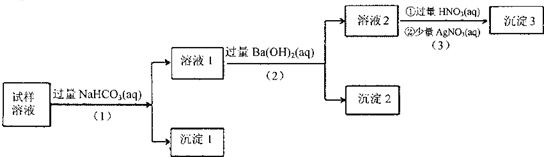
| A. | 沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- | |
| B. | 试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质 | |
| C. | 上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 | |
| D. | 试样溶液中肯定存在A102-、Cl-,其中Na+、K+至少存在1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、Fe3+、NO3-、Cl-可能大量共存 | |
| B. | 和溴水反应的离子方程式:Br2+SO32-+H2O=2H++2Br-+SO42- | |
| C. | 和Ba(OH)2溶液加热反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 1L0.1mol•L-1该溶液和足量的硝酸充分反应,生成2.24L(标准状况)SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
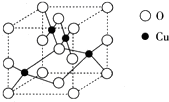 第Ⅵ族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第Ⅵ族元素的化合物在研究和生产中有许多重要用途,请回答下列问题.
第Ⅵ族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第Ⅵ族元素的化合物在研究和生产中有许多重要用途,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 地沟油经过处理,可用来制造肥皂 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
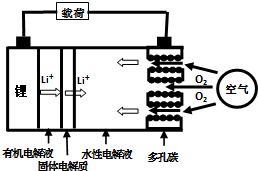 金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )
金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度.它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )| A. | 放电时,空气极为负极 | |
| B. | 放电时,电池反应为:4Li+O2=2Li2O | |
| C. | 有机电解液可以是乙醇等无水有机物 | |
| D. | 在更换锂电极的同时,要更换水性电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将物质的量浓度为10-3mol/L的醋酸和pH=11的NaOH溶液等体积混合后,溶液显碱性 | |
| B. | 如图可表示常温下,稀释HA、HB两种酸的稀溶液时溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 | |
| C. | 25℃时,pH=2的1.0 L 醋酸溶液中水电离出的H+的数目为10-12NA | |
| D. | 某吸热反应能自发进行,则该反应一定是熵增的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$ (g)+3H2(g)△H
(g)+3H2(g)△H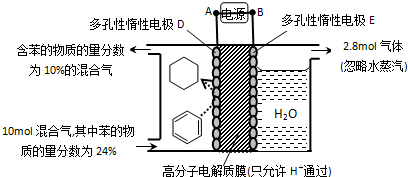
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①装置可验证酸性:H2CO3>H2SiO3 | |
| B. | 图②装置可用于收集气体H2 CO2 Cl2 NH3 | |
| C. | 图③装置可用于分离CCl4萃取碘水后的有机层和水层 | |
| D. | 图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com