
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
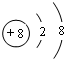 ;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为
;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为 .
.分析 短周期元素中,A的单质是密度最小的物质,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则B为Na;C的原子最外层电子数是其内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B(Na)同周期,该周期中D的简单离子半径最小,则D为Al;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,则E为Cl,Y为NaClO;F元素最高正价与最低负价的代数和为4,则F为S元素,据此解答.
解答 解:短周期元素中,A的单质是密度最小的物质,则A为H元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则B为Na;C的原子最外层电子数是其内层电子数的三倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B(Na)同周期,该周期中D的简单离子半径最小,则D为Al;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,则E为Cl,Y为NaClO;F元素最高正价与最低负价的代数和为4,则F为S元素.
(1)D的离子为O2-,离子结构示意图是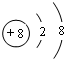 ;化合物Y为NaClO,含有离子键、共价键,Na2O2的电子式表示为
;化合物Y为NaClO,含有离子键、共价键,Na2O2的电子式表示为 ,
,
故答案为: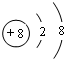 ;离子键、共价键;
;离子键、共价键; ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2->Cl->Al3+,
故答案为:S2->Cl->Al3+;
(3)两种均含H、Na、O、S四种元素的化合物为NaHSO4、NaHSO3,在溶液中相互反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
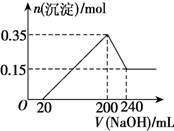
(4)根据图象可知,氢氧化镁为0.15mol,根据Mg元素守恒,可知金属Mg的质量为0.15mol×24g/mol=3.6g;
生成氢氧化铝沉淀的物质的量为:0.35mol-0.15mol=0.2mol,溶解0.2mol氢氧化铝消耗氢氧化钠的物质的量为0.2mol,氢氧化钠溶液的体积为:240mL-200mL=40mL,则该氢氧化钠溶液的浓度为:$\frac{0.2mol}{0.04L}$=5mol/L,当加入200mL氢氧化钠溶液时,沉淀的物质的量达到最大,此时溶质为硫酸钠,则消耗硫酸的物质的量为:$\frac{0.2L×5mol/L}{2}$=0.5mol,所以该硫酸的浓度为:$\frac{0.5mol}{0.5L}$=1mol/L,
故答案为:3.6g;1mol/L.
点评 本题考查位置、结构与性质的关系应用,正确推断各元素名称为解答关键,注意掌握元素周期表结构、元素周期律内容,(4)中计算为难点,需要明确图象中曲线变化的含义.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2 | B. | H2S | C. | S | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑灭 | |
| C. | 皮肤溅上浓H2SO4,应先用干布擦拭并立即用大量水冲洗 | |
| D. | 用激光笔的光束分别照射Fe(OH)3胶体与Na2SO4溶液时的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L CO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 标准状况下,22.4L氖气含有原子数为Na | |
| C. | 物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4NA | |
| D. | 标准状况下,11.2L H2O含有0.5NA分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com