
在标准状况下
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3,
下列对这四种气体的关系从大到小表达正确的是
A.体积②>③>①>④ B.密度②>③>①>④
C.质量②>③>①>④ D.氢原子个数②>④>③>①
科目:高中化学 来源:2010年江苏省盐城中学高一上学期期中考试化学试卷 题型:填空题
(1)在标准状况下,有下列物质①4gH2,②33.6LCH4, ③1molH2O,④3.01×1023个O2。其
中含分子数最多的是(填序号,下同) ,质量最大的是 ,体积最小的 ;密度由大到小的顺序为 。
(2)实验室从海藻(含碘元素,以碘离子的形式存在)中提取碘的流程如下:
已知2KI+Cl2=2KCl+I2,步骤④的目的是从含碘的有机溶液中分离出单质碘和回收有机溶液。w.w.^w.k.&s.5*u.c.#om高.考.资.源.网
I.提取碘的过程中有关的实验操作名称:③ 。
II.有下列实验仪器:A.烧杯 B.玻璃棒 C.表面皿 D.分液漏斗 E.酒精灯
步骤①中必须用到的有(填序号) ,还缺少的玻璃仪器有 。
III.提取碘的过程中,选用的萃取剂可以是 。
A.四氯化碳 B.汽油 C.酒精 D.醋酸
(3)写出实验室制取氯气的化学方程式 。w.w.^w.k.&s.5*u.c.#om高.考.资.源.网
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学三轮复习排查 专题15有机化学基础选修5练习卷(解析版) 题型:填空题
某气态烃A在标准状况下的密度为1.25 g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下所示:

(1)A的结构式为 。B中官能团的电子式为 。
(2)反应①的反应类型是 ,反应③的化学方程式为 。
(3)反应②在Cu作催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2~3次。该反应的化学方程式为______________________。

(4)D与碳酸氢钠溶液反应的离子方程式为 。
(5)B、D在浓硫酸的作用下发生反应④,实验装置如图所示:

试管中装入药品后加热。图中X的化学式为 ,其作用是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去。
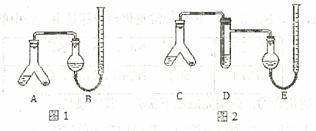
提供的试剂:研细的钙片粉末 (钙片中的其他成分不与盐酸反应)、![]() 盐酸、5%NaOH溶液、饱和
盐酸、5%NaOH溶液、饱和![]() 溶液、饱和
溶液、饱和![]() 溶液和蒸馏水。
溶液和蒸馏水。
实验过程:
Ⅰ.检查两套装置的气密性。
Ⅱ.在A、C的右边加入0.25g钙片粉末,左边加入3mL![]() 盐酸,塞紧塞子。在B、E中均加入饱和
盐酸,塞紧塞子。在B、E中均加入饱和![]() 溶液,如图所示,记下量气管读数。
溶液,如图所示,记下量气管读数。
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得B中收集到的气体为41.90mL,E中收集到的气体体积为39.20mL(以上气体体积均已折算为标准状况下的体积)。
回答下列问题:
(1)Ⅰ中检查图1装置气密性的万法是
。
(2)A中发生反应的离子方程式为 ;
D中加入试剂为 ,D的作用是 。
(3)实验前左右两管液面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是
。
(4)图2实验所得钙片中的碳酸钙的质量分数为 ;图1实验比图 2实验所得钙片中的碳酸钙含量偏高,用离子万程式表示偏高的原因
。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。

甲小组测得:反应前氧化铜的质量为![]() 、氧化铜反应后剩余固体的质量为
、氧化铜反应后剩余固体的质量为![]()
![]() 生成氮气在标准状况下的体积
生成氮气在标准状况下的体积![]() 。
。
乙小组测得:洗气前装置D的质量![]() 、洗气后装置后D的质量
、洗气后装置后D的质量![]() 、生成氮气在标准状况下的体积
、生成氮气在标准状况下的体积![]() 。
。
请回答下列问题:
(1)写出仪器a的名称: 。
(2)检查A装置气密性的操作时 。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③
|
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是 。 为此,乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果。该药品的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
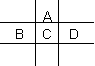
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,
C在周期表中的位置是 ,C的元素名称为 ,
D的单质与水反应的方程式为 。
(3)向D与E形成的化合物的水溶液中逐渐滴入烧碱溶液直至过量,观察到的现象是 ,
有关反应的离子方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com