
【题目】硫酸是一种重要的化学试剂。某实验小组的同学利用浓硫酸进行如下实验。请按要求回答下列问题。
I.制取二氧化硫并探究其性质

(1)装置A中发生反应的化学方程式为___________。上述装置中适于收集二氧化硫的气体是(填字母)____。
(2)将一收集满二氧化硫气体的小试管倒置于滴有紫色石蕊溶液的水中,可观察到的现象是____。
(3)上述实验所产生的二氧化硫尾气可选用E装置来吸收,该反应的化学方程式为_________。
II.处理含正六价铬的废水样液(+6价Cr的含量为78mg/L)。实验步骤如下:
①取1L废水加入一定量1.8mol/LH2SO4溶液使样液酸化
②加入一定量的绿矾(FeSO4·7H2O),将正六价铬转化为正三价铬离子
③加入过量的石灰水,使正三价的铬离子转化为Cr(OH)3沉淀
④过滤,除去沉淀物
(1)配制步骤①中所需的H2SO4溶液l00mL,需用18mol/L H2SO4溶液的体积是______mL。
(2)步骤②中反应的离子方程式为14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O,此反应中氧化剂和还原剂物质的量之比为__________。
(3)处理1L该废水样液至少需用绿矾________g。
【答案】 Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑ C 试管内液面上升,溶液变成红色 2NaOH+SO2=Na2SO3+H2O 10 1:6 1.251
CuSO4+2H2O+SO2↑ C 试管内液面上升,溶液变成红色 2NaOH+SO2=Na2SO3+H2O 10 1:6 1.251
【解析】I.(1)浓硫酸和铜在加热的条件下生成硫酸铜、二氧化硫和水,化学方程式为Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑,二氧化硫易溶于水,密度比空气的大,采用向上排空气法收集,因此选择装置C;(2)二氧化硫溶于水的同时与水反应生成亚硫酸,石蕊溶液遇酸变红色,因此可观察到的现象是:试管内液面上升,溶液变为红色;(3)二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水,化学方程式为2NaOH+SO2=Na2SO3+H2O;
CuSO4+2H2O+SO2↑,二氧化硫易溶于水,密度比空气的大,采用向上排空气法收集,因此选择装置C;(2)二氧化硫溶于水的同时与水反应生成亚硫酸,石蕊溶液遇酸变红色,因此可观察到的现象是:试管内液面上升,溶液变为红色;(3)二氧化硫与过量氢氧化钠反应生成亚硫酸钠和水,化学方程式为2NaOH+SO2=Na2SO3+H2O;
Ⅱ.(1)根据稀释定律可知:100mL×1.8mol/L=V浓×18mol/L,解得V浓=10mL;(2)反应中Cr化合价由+6→+3,化合价降低,因此Cr2O72-作氧化剂,Fe化合价由+2→+3,化合价升高,因此Fe2+作还原剂,根据离子方程式可知氧化剂和还原剂物质的量之比为1:6;(3)1L该废水样液中含有Cr的质量=78mg/L×1L=78mg=0.078g,物质的量=0.078g÷52g/mol=0.0015mol,则Cr2O72-的物质的量=0.5×0.0015mol=0.00075mol,根据Cr2O72-~6Fe2+~6FeSO4·7H2O可知FeSO4·7H2O的物质的量=6×0.00075mol=0.0045mol,FeSO4·7H2O的质量=0.0045mol×278g/mol=1.251g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】环境污染已成为人类社会面临的重大问题,各种污染数不胜数。导致下列污染的主要原因与高分子化合物有关的是( )
A. 酸雨 B. 光化学烟雾
C. 温室效应 D. 白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些电镀厂的酸性废水中常含有一定量的CrO42﹣和Cr2O72﹣ , 它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种
方法1:还原沉淀法,其中第①步存在平衡步存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=12,该溶液显 .
(2)写出第③步的离子反应方程式: .
(3)第②步中,用6mol的FeSO47H2O可还原molCr2O72﹣离子.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3() Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至 .
方法2:电解法:该法用Fe做电极电解含Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)写出阳极的电极反应式 .
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)
(7)用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.6gNa和2.7gAl同时加入到足量的水中充分反应,将反应后的溶液稀释定容为500mL。下列说法不正确的是
A.所得溶液中阳离子和阴离子的物质的量之比为1∶1
B.反应中消耗的水的质量是加入的Al的质量的2倍
C.所得溶液中AlO2-的物质的量浓度为0.2mol/L
D.反应中放出的气体在标准状况下的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中,正确的是
①新制氯水久置后→浅黄绿色消失
②淀粉溶液遇单质碘→蓝色
③蔗糖中加入浓硫酸搅拌→白色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色
⑥用稀盐酸酸化Fe(NO3)2→变黄
⑦浓硝酸涂在蓝色石蕊试纸→变红
⑧Fe(OH)3胶体通电一段时间→正极附近颜色加深
A.①②③④⑥ B.②③④⑤⑦ C.①②④⑤⑥ D.①③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)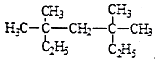 系统命名法为;
系统命名法为;
(2)键线式 ![]() 表示的有机物的结构简式是;
表示的有机物的结构简式是;
(3)醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是 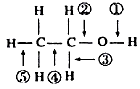
①和金属钠作用时,断裂;
②和浓硫酸共热至170℃时,断裂;
③和乙酸、浓硫酸共热时,断裂;
④在铜催化下和氧气反应时,断裂;
⑤与氢卤酸反应时,断裂;
(4)分子质量为70的烯烃的分子式为 , 若该烯烃与足量H2加成后能生成含3个甲基的烷烃,则该烯烃可能的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为一些常见物质的相互转化关系图。已知:A是金属单质,B为淡黄色粉末,C在常温下为无色液体,J为红褐色固体。
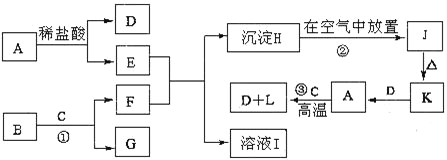
请写出:
(1)A的化学式:A______________
(2)检验溶液E是否变质的方法_________________________________________________。
(3)固体K的一种用途 __________________________________。
(4)反应①的离子方程式___________________________________________。
(5)物质H转化为物质J的现象为 ________________________________________________________,反应②的化学方程式为 ____________________________________________________________。
(6)反应③的化学方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法能够成功制备Fe(OH)3胶体的是( )
A. 将1 mL饱和FeCl3溶液加入到20 mL NaOH溶液
B. 将1 mL饱和FeCl3溶液逐滴加入到20 mL温水中,边加边振荡,并加热到沸腾
C. 将1 mL饱和FeCl3溶液一次性加入到20 mL沸水中,并加以搅拌
D. 将5-6滴饱和FeCl3溶液逐滴加入到20 mL沸水中,继续煮沸至呈红褐色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com