
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请按要求回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)用序号回答:
①—元素中,_________形成的气态氢化物最稳定;化学性质最不活泼原子是_______;_______的最高价氧化物的水化物呈两性;用中文“![]() ”(ào)命名的第118号元素与_____同一族。
”(ào)命名的第118号元素与_____同一族。
(2)用“>”“<”回答:
原子半径:⑥___________⑦;离子半径:⑤___________⑧。
(3)用化学用语回答:
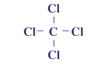
⑥的原子结构示意图是______________;②和形成的化合物的结构式是___________;
⑩的气态氢化物的化学式是____________;的最高价含氧酸的化学式是____________。
(4)①和④两种元素的原子按2:1组成的常见化合物的电子式为________________。①和③两种元素的原子按5:1组成化合物,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,它的电子式为___________________。
(5)⑦⑧两元素相比较,金属性较强的是_________________(填名称),可以验证该结论的实验是_____________(填字母)。
A 将在空气中放置已久的这两种元素的块状单质分别放入热水中
B 将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
C 将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
D 比较这两种元素的气态氢化物的稳定性
【答案】⑤ ⑧ > > 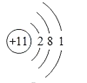
 PH3 HClO4
PH3 HClO4 ![]()
 镁 BC
镁 BC
【解析】
根据所给元素在周期表中位置,推出12种元素分别为H、C、N、O、F、Na、Mg、Al、Si、P、Cl、Ar,然后逐题分析;
(1)非金属性越强,其气态氢化物稳定性越强,同周期从左向右非金属性增强(稀有气体除外),同主族从上到下非金属性减弱,即所给元素中非金属性增强的是F,即气态氢化物稳定性最强的是⑤;化学性质最不活泼是稀有气体,即;氢氧化物表现两性,指的是氢氧化铝,即⑧;按照核外电子排布的规律,118号元素核外电子示意图为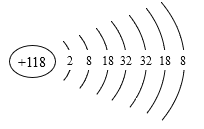 ,即118号元素位于第七周期0族,118号元素与属于同主族;
,即118号元素位于第七周期0族,118号元素与属于同主族;
(2)同周期从左向右原子半径减小,即⑥>⑦,⑤和⑧离子分别是F-、Al3+,它们核外电子排布相同,即离子半径⑤>⑧;
(3)⑥为Na,11号元素,即原子结构示意图为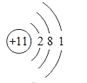 ;②和形成的化合物是CCl4,其其结构式为
;②和形成的化合物是CCl4,其其结构式为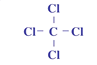 ;⑩的气态氢化物是PH3;的最高价含氧酸是HClO4;
;⑩的气态氢化物是PH3;的最高价含氧酸是HClO4;
(4)H和O形成的化合物是H2O和H2O2,原子按2:1组成,即为H2O,其电子式为![]() ;H和N两种元素的原子按5:1组成化合物,该化合物化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外层电子层结构,即电子式为
;H和N两种元素的原子按5:1组成化合物,该化合物化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外层电子层结构,即电子式为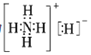 ;
;
(5)同周期从左向右金属性减弱,即Mg和Al金属性较强的是Mg,
A、在空气防止已久,金属表面产生氧化膜,MgO和Al2O3不与热水反应,不能判断金属性强弱,故A不符合题意;
B、观察与盐酸反应的速率,金属性强的与盐酸反应速率快,能够判断金属性强弱,故B符合题意;
C、将形状、大小相同这两种元素的单质分别和热水反应,并滴入酚酞,溶液碱性越强,说明金属性越强,故C符合题意;
D、二者都是金属,没有气态氢化物,不能根据氢化物的稳定性判断金属性强弱,故D不符合题意。


科目:高中化学 来源: 题型:
【题目】常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
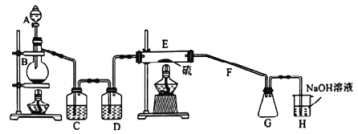
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
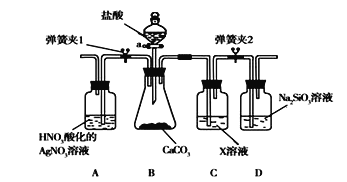
实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2当…时,关闭活塞a。
请回答:
(1)盛放盐酸的仪器名称是___________。
(2)通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.酸性 B.还原性 C.氧化性 D.挥发性
(3)C装置中的X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写出的现象是___________________。
若通入D中的CO2足量,D中发生反应的离子方程式是______________________。
(5)碳、硅的非金属性逐渐减弱的原因是_____________________(从原子结构角度加以解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
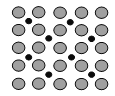
【题目】(1)诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,图为氮原子在铁的晶面上的单层附着局部示意图(图中小的黑色球代表氮原子,大的灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N/Fe原子数比值的最大值为________________。
(2)Cu与O形成的某种化合物X,其晶胞结构如下图所示。O在顶点和体心。已知X晶胞中原子坐标参数:A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C原子的坐标参数为___________。
),则C原子的坐标参数为___________。

物质结构用到多种模型,请结合模型完成下列问题:

(3)D图是CaTiO3晶胞模型,同一种微粒位置相同,Ca2+位于立方体的体心,则Ti4+位于____(填顶点或面心)
(4)已知A图是CsCl晶胞模型,体心为Cs+,与其紧邻等距离的Cs+数目有___________个。
(5)某分子中原子空间位置关系如B图所示,X位于立方体的顶点,Y位于立方体中心,用X,Y表示的化学式为______________。
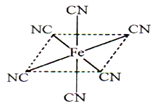
(6)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其阴离子结构如图。写出上述沉淀溶解过程的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
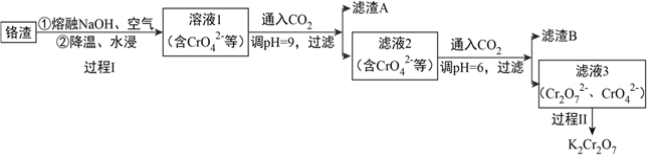
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,能证明某物质是弱电解质的是( )
A.熔融时不导电
B.水溶液的导电能力很差
C.不是离子化合物,而是极性共价化合物
D.溶液中已电离的离子和未电离的分子共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A与E同主族,E的单质是良好的半导体材料,D+核外电子排布与C2-相同。试回答(涉及到的物质均用化学式作答):
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D的简单离子所含电子数和质子数都相同的微粒是____________(写一个即可)。
(3)A、B和E最高价氧化物对应的水化物中,酸性最弱的是_________________(写化学式)。若用如图中装置验证这三种酸的酸性强弱,则在装置A中应加入______(写化学式),烧杯C观察到的实验现象是_____________________________。该实验装置存在不足,影响到实验目的的达成,改进方法是_____________。
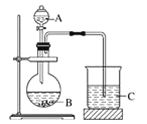
(4)B的最高价氧化物对应的水化物的稀溶液与B的气态氢化物反应的化学方程式为_____________
(5)用电子式表示D2C的形成过程:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程,属于吸热反应的是( )
①碳与水蒸气反应 ②将胆矾加热变为白色粉末 ③浓H2SO4稀释 ④氯化铵晶体溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)28H2O混合搅拌 ⑧碳酸钙热分解.
A. ①②④⑥⑦⑧ B. ①②⑥⑦ C. ④⑥⑦⑧ D. ①②⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com