
| A. | 标准状况下,224 mL水中含有的电子数为0.1NA | |
| B. | 44 g由N2O和CO2组成的混合气体中含有的原子数为3NA | |
| C. | 将20 mL 0.5 mol•L-1 FeCl3溶液煮沸,所得胶粒数目为0.01NA | |
| D. | 在反应:KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3mol Cl2,转移的电子数为6NA |
分析 A.标况下水的状态不是气体;
B.二者摩尔质量都是44g/mol,都含有3个原子,根据n=$\frac{m}{M}=\frac{N}{{N}_{A}}$计算;
C.氢氧化铁胶粒为氢氧化铁的聚集体;
D.KClO3中+5价Cl元素被还原成0价,化合价变化为5,则生成3mol氯气转移5mol电子.
解答 解:A.标准状况下水不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.44 g由N2O和CO2组成的混合气体的物质的量为:$\frac{44g}{44g/mol}$中含有的原子数为3NA,故B正确;
C.将20 mL 0.5 mol•L-1 FeCl3溶液煮沸,由于氢氧化铁胶粒为氢氧化铁的聚集体,则无法计算所得胶粒数目,故C错误;
D.在反应KClO3+6HCl═KCl+3Cl2+3H2O中,KClO3中+5价Cl元素被还原成0价,化合价变化为5,则每生成3mol Cl2转移5mol电子,转移的电子数为5NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件为解答关键,试题培养了学生的化学计算能力.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

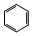 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$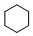
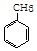 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$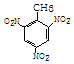 +3H2O,反应类型取代反应
+3H2O,反应类型取代反应 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B能形成离子化合物,且A离子半径小于B离子半径 | |
| B. | A、D能形成离子化合物DA5,与H2O反应能生成A的单质 | |
| C. | C、D的简单氢化物中只有D溶于水,其水溶液呈酸性 | |
| D. | E的两种氢化物中所有化学键种类完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| 反应能量变化 | 放出29.4KJ | 吸收aKJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
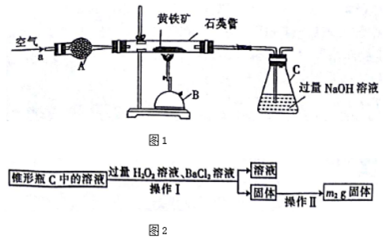
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 25℃,两片相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | 将无水乙醇和浓H2SO4的混合物加热至170℃,产生的气体通入酸性KMnO4溶液 | KMnO4溶液紫红色褪去 | 乙烯具有还原性 |
| C | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
| D | 向盛有AgCl固体试管中加入一定量的0.01mol•L-1 KI溶液 | 固体由白色逐渐变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
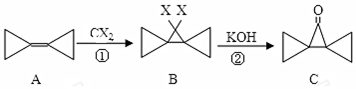
| A. | 反应①是加成反应 | B. | A的所有原子都在一个平面内 | ||
| C. | 反应②是消去反应 | D. | A的二氯代物只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
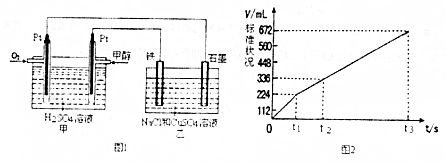
 美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.
美国已计划将甲醇燃料电池用于军事.一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解质中直接加入纯化后的甲醇,同时向一个电极通入空气.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com