
| A、1mol任何物质都含有约6.02×1023个原子 |
| B、常温常压下,4.4 g CO2气 体含有6.02×1022个CO2分子 |
| C、常温常压下28 g CO与22.4 L O2所含分子数相等 |
| D、标准状况下,33.6 L H2O含有9.03×1023个H2O分子 |
| m |
| M |
| 4.4g |
| 44g/mol |


科目:高中化学 来源: 题型:
| A、K+.Ag+.Na+.Cl- |
| B、K+.Na+.NO3-.CO32- |
| C、Na+.H+.NO3-.SO42- |
| D、Fe3+.Na+.Cl-. SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向稀硫酸溶液中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
| B、向NaOH溶液中加入醋酸:H++OH-═H2O |
| C、向硝酸银溶液中加入盐酸:Ag++Cl-═AgCl↓ |
| D、向氢氧化钡溶液中加入硫酸铜溶液:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:4 |
| C、3:4 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式:CH2CH2 |
| B、乙醇含有的官能团是-OH,带一个单位负电荷 |
C、丙烷的球棍模型为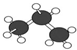 |
| D、乙酸的分子式:C2H4O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O2固体中含离子总数为4NA |
| B、将含0.1 mol FeCl3的饱和溶液制成胶体后,生成0.1NA个Fe(OH)3胶粒 |
| C、高温下,0.3 mol Fe与足量水蒸气反应,生成的H2分子数目为0.4 NA |
| D、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该气体的相对分子质量是44 |
| B、该气体的体积是22.4L |
| C、该气体的质量是44G |
| D、该气体的原子数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com