
【题目】对于可逆反应H2(g)+I2(g)![]() 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B.正、逆反应速率的比值是恒定的
C.达到平衡时,正、逆反应速率相等
D.达到平衡时,H2(g)和I2(g)浓度不在变化且相等
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铜和过量的浓HNO3反应:3Cu +8H+ +2NO![]() = 3Cu2++ 2NO↑+4H2O
= 3Cu2++ 2NO↑+4H2O
B.CaCO3和盐酸反应:2H++CaCO3 =Ca2+ +CO2 ↑+H2O
C.向NH4HCO3溶液中加过量Ca(OH)2溶液并加热:NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
D.将Ba(OH)2滴加到稀硫酸中:Ba2+ + SO![]() = BaSO4 ↓
= BaSO4 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2molSO2和1molO2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
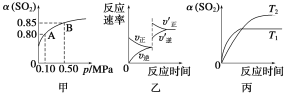
A.由图甲知,A点SO2的平衡浓度为0.08mol·L-1
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达到平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50MPa时不同温度下SO2的转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如图。
I
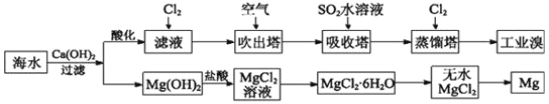
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是______,吸收塔中发生反应的离子方程式是__________。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是____、浓缩、冷却、______、过滤、洗涤、干燥。
II以食盐为原料进行生产并综合利用的某些过程如图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO![]() 离子,加入下列沉淀剂的顺序是(填序号)____。
离子,加入下列沉淀剂的顺序是(填序号)____。
a.BaCl2 b.Na2CO3
(2)NaHCO3制取Na2CO3化学方程式是_____。
(3)将滤液的pH调至酸性除去的离子是______。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是_____。
(5)工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是_______。(已知碳酸的酸性强于次氯酸)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:
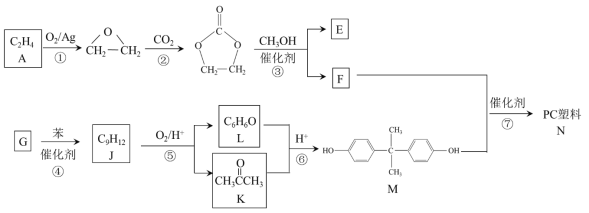
已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
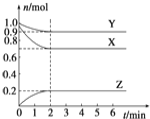
(1)该反应的化学方程式为_____________________ ;
(2)反应开始至2 min,气体Z的平均反应速率为_________;
(3)当反应达平衡时后:若X、Y、Z均为气体,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应为_____反应(填放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究化合物A(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
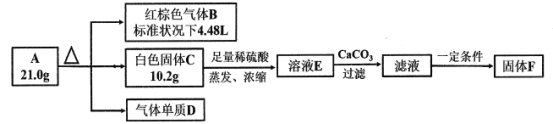
已知:白色固体C既能与强酸反应,也能与强碱反应。
请回答:
(1)写出A受热分解的化学方程式为___________________________________________。
(2)请设计实验方案检验溶液E中所含的阳离子_________________________________。
(3)若固体F中金属元素的百分含量为19.29%,硫为22.86%,氧为57.14%,且300 g/mol<MF<450 g/mol,则F的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com