
【题目】顺铂是一种用于治疗癌症的药物,它的结构如下图所示。关于1 mol顺铂的下列说法中,正确的是( )
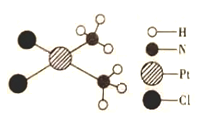
A.含氮元素的质量为14gB.含铂原子的数目约为6.02×1024
C.含氯元素的质量为35.5gD.含氢原子的物质的量6 mol
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是一种重要金属,号称国防金属。某设计小组利用硼镁矿制备镁和硼的流程如下:
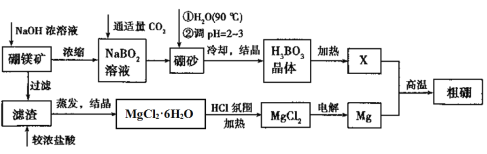
已知:硼镁矿的主要成分Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O,回答下列问题:
(1)Mg2B2O5·H2O中B的化合价为________。在90℃的热水中,加入稀硫酸调节pH=2~3生成硼酸(H3BO3),反应的离子方程式为__________。
(2)硼的化合物种类繁多,NaBH4是有机合成中常见的还原剂,NaBH4的电子式为______。
(3)将MgCl2·6H2O置于HCl氛围中加热的目的是_____,Mg与X在高温下反应的化学方程式为________。
(4)若向硼镁矿中加入0.1 mol/L盐酸溶液,充分反应后测得溶液的pH=2时,溶液中c(Mg2+)为__________________________________(忽略溶液体积的变化)。
(5)电解熔融的无水氯化镁所得的镁蒸汽在特定的环境里冷却后即为固体镁,下列物质中可以作镁蒸汽的冷却剂的是_________(填字母序号)
A氦气 B氮气
C水蒸气 D二氧化碳气体 E氯气
(6)Mg-H2O2是一种以海水为电解质(加入一定量的酸)的新型电池。该电池的负极材料为_____,正极的电极反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AG表示溶液酸度:![]() 。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
。常温下,用0.1mol/L的NaOH溶液滴定25 ml 0.1mol/L的CH3COOH滴定结果如图所示,下列分析正确的是()
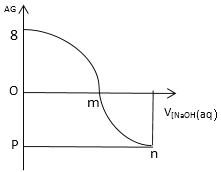
A.0.1mol/L的 CH3COOH溶液的pH=3
B.m点加入NaOH的体积为25mL
C.若pH=7,则溶液中水电离的c(OH-)=1.0×10-3.5 mol/L
D.随着NaOH溶液滴入,溶液中水的电离程度逐渐增大,m点最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
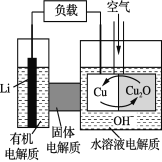
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中常用84消毒液杀菌消毒。化学课外小组用Cl2和NaOH固体制取84消毒液。请回答下列问题:
(1)制取84消毒液的离子方程式为______________________。
(2)制取84消毒液需要4.0 mol·L-1的NaOH溶液100mL,配制时称量NaOH固体的质量为________,配制过程中使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、_________。
(3)该消毒液也用于漂白,为增强漂白性向消毒液中滴加几滴稀盐酸,写出化学反应方程式__________________。
(4)84消毒液在空气中久置后,NaClO会转化为HClO,HClO分解失效,化学课外小组同学向溶液中滴加紫色石蕊试液,出现______________现象,证明消毒液已失效。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
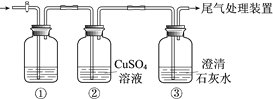
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水![]() 的制备流程如下:
的制备流程如下:
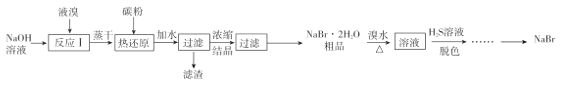
已知:①![]() ;
;
②![]() 溶于
溶于![]() 溶液生成
溶液生成![]() ,离子方程式可表示为
,离子方程式可表示为![]() 。
。
请回答:
(1) “反应I”所用![]() 溶液最好是饱和溶液,理由是____________
溶液最好是饱和溶液,理由是____________
(2)已知“热还原”反应中,氧化剂和还原剂物质的量之比为![]() ,若该反应中消耗了
,若该反应中消耗了![]() 碳粉,则理论上最终可制得
碳粉,则理论上最终可制得![]() 的质量为_____________(不考虑制备过程中的损失)。
的质量为_____________(不考虑制备过程中的损失)。
(3)“脱色”过程中生成了两种强酸,写出该过程的离子方程式:______________________
(4)用![]() 与
与![]() 溶液反应是制备
溶液反应是制备![]() 的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
的另一种方法,反应过程中有气体和沉淀生成,写出此方法的化学方程式:___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com