
【题目】20℃时,用0. 1mol/L 盐酸滴定20mL 0. 1mol/L 氨水的图像如图所示,下列说法正确的是
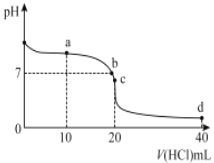
A.a点时2c(Cl-)=c(NH3H2O)+c (NH4+)
B.b点表示酸碱恰好完全反应
C.c点时c(NH4+)>c(Cl-)>c(H+ )>c(OH- )
D.a 、b、c、d均有c(NH4+)+c(H+) = c(Cl-)+c(OH-)
【答案】AD
【解析】
用0. 1mol/L 盐酸滴定20mL 0. 1mol/L 氨水的过程中溶液中的溶质的变化依次为:氨水、氨水和氯化铵、氯化铵、氯化铵和盐酸,溶液中的pH变化为从大到小。
A. a点时加入10mL的盐酸,溶液中的溶质为等物质的量的氨水和氯化铵,根据物料守恒有氮原子的物质的量是氯原子的物质的量的2倍,即2c(Cl-)=c(NH3H2O)+c (NH4+),故A正确;
B.酸碱恰好完全反应时应该加入0. 1mol/L 盐酸20mL,即酸碱恰好完全反应的点为c点,而不是b点,故B错误;
C. c点溶液中的溶质为氯化铵,显酸性,根据电荷守恒可知正确的离子排序为c(Cl-)> c(NH4+)>c(H+ )>c(OH- ),故C错误;
D. a 、b点溶液中的溶质为氨水和氯化铵,c点溶液中的溶质为氯化铵,d点溶液中的溶质为氯化铵和盐酸,根据电荷守恒都有c(NH4+)+c(H+) = c(Cl-)+c(OH-),故D正确;
综上所述,答案为AD。


科目:高中化学 来源: 题型:
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。
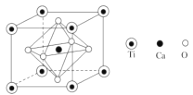
(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)![]() 溶液显酸性,试用离子方程式解释其原因________。
溶液显酸性,试用离子方程式解释其原因________。
(2)氯化银在水中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),在25C时,氯化银的![]() ,现将足量氯化银分别放入:①
,现将足量氯化银分别放入:①![]() 氯化镁溶液中,②
氯化镁溶液中,②![]() 硝酸银溶液中,③
硝酸银溶液中,③![]() 氯化铝溶液中,④
氯化铝溶液中,④![]() 盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是___________(填写序号)。
(3)下表所示的是常温下,某些弱酸的电离常数,请根据要求作答。
弱酸 | 电离常数 | 弱酸 | 电离常数 |
|
|
|
|
|
|
|
|
①相同物质的量浓度的![]() 和
和![]() 的混合溶液中离子浓度由大到小的顺序为_________。
的混合溶液中离子浓度由大到小的顺序为_________。
②请判断![]() 溶液显_________性(填“酸”、“碱”或“中”)。
溶液显_________性(填“酸”、“碱”或“中”)。
③下列离子方程式书写正确的是_______。
A. HC2O4-+SO32-═HSO3-+C2O42-
B. 2CH3COOH+SO32-═2CH3COO-+H2O+SO2↑
C. SO2+H2O+2CH3COO-═2CH3COOH+SO32-
D. 2CO32-+SO2+H2O═2HCO3-+SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将0.1mol·L-1的烧碱溶液不断滴加到10.00mL相同浓度的HA溶液中,溶液中-lgc水(H+)与NaOH溶液的体积关系如图所示[注:c水(H+)为溶液中水电离的c(H+)]。下列说法不正确的是( )
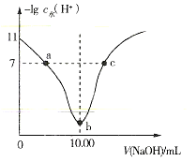
A.a、c两点溶液中均存在:c(H+)+c(Na+)=c(OH-)+c(A-)
B.b点溶液中存在:c(H+)+c(HA)=c(OH-)
C.a、b、c三点溶液中,b点溶液导电性最强
D.0.1mol·L-1HA溶液中HA的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学为测定该盐酸的浓度,在实验室中进行了如下实验。
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→冷却→转移→洗涤(并将洗涤液移入容量瓶)→振荡→_________→__________→装瓶→贴标签。
②称量________g氢氧化钠固体粉末,所需仪器有:托盘天平(带砝码和镊子)、___________、小烧瓶。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) | |
1 | 0.10 | 29.80 | 20.00 | |
2 | 0.10 | 30.00 | 20.00 | |
3 | 0.10 | 30.20 | 20.00 |
①滴定达到终点的标志是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为_______(保留两位有效数字)。
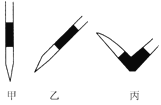
③排去碱式滴定管中气泡的方法应采用如图所示操作中的____________(选择甲、乙、丙填空),然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家分析,地球原始大气中的COS(羰基硫)对氨基酸缩合形成多肽的反应有催化作用,对生命起源起到重要作用。
(1)写出COS的电子式________,C与O形成共价键时,共用电子对会偏向____原子,判断依据是___________。
(2)已知 COS(g)+ H2O(g)![]() H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
H2S(g)+ CO2(g) ΔH1 = - 34kJ/mol
CO(g)+ H2O(g)![]() H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
H2(g)+ CO2(g) ΔH2 = - 41kJ/mol
写出H2S与CO反应生成 COS 的热化学方程式:_________;100℃ 时将CO与H2S按物质的量比为 1:1 充入反应器中,达平衡后CO的转化率α = 33.3%,此时反应的平衡常数K =______。
(3)在充有催化剂的恒压密闭容器中进行反应。 设起始充入的 n(CO):n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
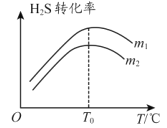
①m1________m2。(填“ > ”、“ < ”或“ = ”)
②温度高于 T0时,H2S 转化率减小的可能原因为________。
A 反应停止了
B 反应的 ΔH 变大
C 反应达到平衡
D 催化剂活性降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。
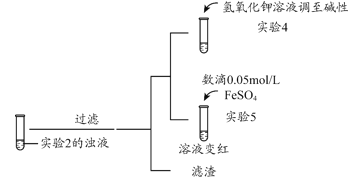
补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
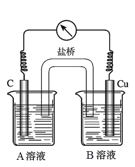
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
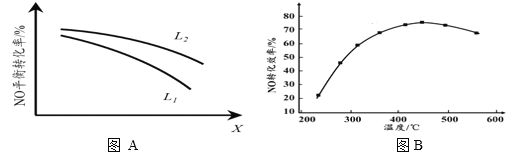
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
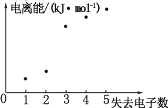
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用 R代表)。 回答下列问题:
(1)基态氮原子价层电子的轨道表示式为_____。
(2)氯离子的基态电子排布式为_____,有_____种不同能级的电子。
(3)R 中 H、N、O 三种元素的电负性由大到小的顺序是_____(用元素符号表示)。
(4)如图表示短周期元素 X 的基态原子失去电子数与对应电离能的关系,试推测 X 与R 中的_____(填元素符号)元素同周期。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com