
反应2A(g)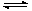 2B(g)+C(g) △H>0,要使逆反应速率增大,A的浓度减小(只改变一个条件),应采取的措施是 ( )
2B(g)+C(g) △H>0,要使逆反应速率增大,A的浓度减小(只改变一个条件),应采取的措施是 ( )
A.减压 B.升温
C.加入合适的催化剂 D.增大B的浓度
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
已知离子方程式:As2S3+H2O+NO ―→AsO
―→AsO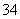 +SO
+SO +NO↑+________(未配平),下列说法错误的是 ( )。
+NO↑+________(未配平),下列说法错误的是 ( )。
A.配平后水的化学计量数为4
B.反应后溶液呈酸性
C.配平后氧化剂与还原剂的物质的量之比为3∶28
D.氧化产物为AsO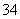 和SO
和SO
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有较大量的Cl—、CO2-3、OH—三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次沉淀出来,下列实验操作顺序正确的是 (D)
①滴加Mg(NO3)2溶液②过滤③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③ B.④②③②①
C.①②③②④ D.④②①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
有一无色溶液,可能含有K+.Al3+.Mg2+.NH4+.Cl-.SO42-.HCO3-.MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
A.肯定有Al3+.Mg2+.NH4+.Cl- B.可能有K+.Cl-.MnO4-
C.肯定有Al3+.Mg2+.SO42- D.肯定有K+.HCO3-.MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
“化学,我们的生活,我们的未来”是2011年“国际化学年”的主题。下列行为中不符合这一主题的是 ( )
A.控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源
B.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
C.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
D.实现资源的“3R”利用,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle)
查看答案和解析>>
科目:高中化学 来源: 题型:
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作导致结果偏低的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失
D.滴定前读数正确,达到滴定终点后,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是 ( )
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以均Al(OH)3的形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列分离装置进行相应实验,能达到相应实验目的的是
( )。
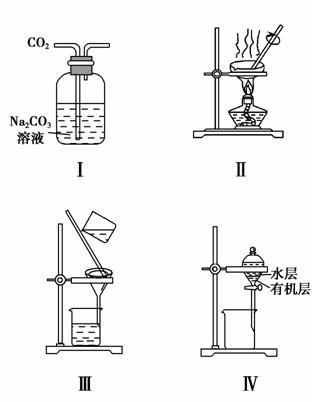
A.用图Ⅰ所示装置除去CO2中含有的少量HCl
B.用图Ⅱ所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图Ⅲ所示装置分离NaCl和Na2SO4的混合溶液
D.用图Ⅳ所示装置分离CCl4萃取碘水中的碘后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用浓硝酸、铜片、水等试剂探究浓、稀硝酸的强氧化性并观察还原产物的实验装置。

Ⅰ.浓硝酸的强氧化性实验
将铜片置于具支试管的底部,在分液漏斗中加入约5 mL浓硝酸,往具支试管中放入约2 mL浓硝酸,用排水法收集产生的气体。
(1)具支试管中发生反应的化学方程式:_________________________。
(2)实验中观察到能证明浓硝酸具有强氧化性的现象_______________ ______________________________________________________________。
Ⅱ.稀硝酸的强氧化性实验
(3)上述反应完成后,欲进一步证明稀硝酸也具有强氧化性,紧接的简便、合理的实验操作是_________________________________________。
(4)能证明稀硝酸与铜反应产生NO的实验现象是________(填写序号)。
A.c中收集到无色气体
B.c中收集到的无色气体接触空气后变为红棕色
C.b中产生的无色气体接触空气后变为红棕色
Ⅲ.实验反思
(5)利用该装置先进行铜与浓硝酸反应,再进行铜与稀硝酸反应的实验,其好处是____________________________________。
Ⅳ.问题讨论
用等质量的铜片与等体积的浓硝酸、稀硝酸(硝酸均过量)反应时,发现反应后所得溶液前者呈绿色,后者呈蓝色。对此有两种看法:
①两者颜色不同的原因是因为Cu2+浓度差异引起的。
②前者溶液呈绿色,是因为生成的红棕色NO2溶解于溶液中引起的。
(6)你认为上述看法________(填“①”或“②”)合理。若是①合理,说明理由,若是②合理,设计一个简单实验证明:______________________ _________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com