
【题目】如图甲池和乙池中的四个电极都是铂电极,乙池溶液分层,上层溶液为盐溶液,呈中性。请根据图示判断下列有关说法正确的是:( )
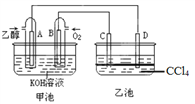
A. 甲池的电解池,乙池是原电池
B. 通入乙醇的铂电极反应式为C2H5OH+16OH-+12e-=2CO32-+11H2O
C. 反应一段时间后,两池溶液的pH均未变化
D. 假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)

A. ②中试剂为饱和NaHCO3溶液
B. 打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
C. 苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
D. ③中发生反应的化学方程式是2![]() +CO2 +H2O
+CO2 +H2O![]() +Na2CO3
+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其PH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A. HX,HZ,HY B. HX,HY,HZ C. HZ,HY,HX D. HY,HZ,HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
是重要的工业原料,铀浓缩一直为国际社会关注。下列说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 为同一核素
为同一核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于有机合成催化。例如 回答下列问题:
回答下列问题:
(1)CuCl中Cu+核外电子排布式为______________,Cu与Cl相比,第一电离能较大的是______________。
(2)已知![]() 为平面分子,则-CHO中碳原子的杂化方式为______________。
为平面分子,则-CHO中碳原子的杂化方式为______________。
(3)写出与CO互为等电子体的非极性分子的电子式______________,14gCO中含______________molπ键。合成氨工业中用铜洗液吸收CO,形成配合物[Cu(NH3)3CO]Ac(HAc代表醋酸),其中______________ (填粒子符号)接受孤对电子形成配位键,配位数是______________。
(4)铜钙可形成合金,单质铜的熔点比单质钙高,其原因是____________________________,其中一种合金的晶胞结构构如图所示,已知:该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值,则其中两个Ca原子核之间距离为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4 ℃下,把质量A g摩尔质量为M g·mol-1的可溶性盐RCln 溶解在V mL水中,恰好形成该温度下的饱和溶液,密度为ρ g·cm-3,下列关系式错误的是
A. 溶质的质量分数ω=A/(A+V)×100%
B. 溶质的物质的量浓度c=1 000ρ A/(MA+MV) mol·L-1
C. 该温度下此盐的溶解度S=100A/V g
D. 1 mL该溶液中n(Cl-)=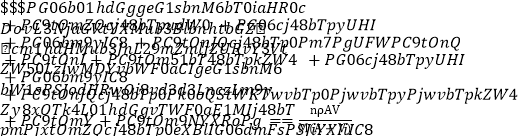 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z。X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则:
(1)写出元素符号:X_______, Y _________ ; Z的离子结构示意图为__________。
(2)由Y、Z组成,且质量比为7:20的化合物化学式为____________ 。
(3)X、Z可以形成两种常见化合物A和B,A中X、Z原子个数比为2 : 1,则A的摩尔质量为_____,实验室常用B制少量的氧气,写出化学反应方程式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:
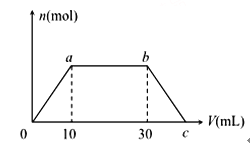
(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池若不进行回收利用,将对水体产生严重污染。某兴趣小组对废旧镍电池正极材料[由Ni(OH)2、碳粉、Fe2O3等涂覆在铝箔上制成]进行回收研究,设计实验流程如下图所示:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+,Cl2能氧化Ni2+为Ni3+;
②NiO+2HCl=NiCl2+H2O;
③Fe3+、Al3+、Ni3+以氢氧化物形式沉淀时溶液的pH如下表所示:
离子 | Fe3+ | Al3+ | Ni2+ |
开始沉淀时的pH | 1.5 | 3.5 | 7.0 |
完全沉淀时的pH | 3.2 | 4.8 | 9.0 |
④Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
请回答下列问题:
(1)酸溶后所留残渣的主要成份__________(填物质名称)。
(2)步骤X的操作为用NiO调节溶液pH,首先析出的沉淀Ⅰ是__________(填化学式),调节过程中pH不能低于___________。
(3)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则加入Na2C2O4溶液后析出的沉淀是__________。
(4)写出生成沉淀Ⅲ的离子方程式__________,该反应的平衡常数为__________。
(5)用化学反应方程式表示沉淀Ⅲ转化为Ni(OH)3________________________。
(6)过滤③后如何检验Ni(OH)3已洗涤干净____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com