
反应SO2(g)
+ NO2(g)  NO(g) + SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 (
)
NO(g) + SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 (
)
A.平衡左移,容器内压强不一定增大
B.平衡右移,达到平衡时容器内压强一定增大
C. 平衡右移,SO2的转化率提高
D.平衡不一定移动,容器内压强一定增大
科目:高中化学 来源: 题型:
【化学——化学与技术】(15分)硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
的郊区(填选项的标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸较多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。若反应:SO2(g)+1/2O2(g)=SO3(g) △H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用, 请通过计算判断每生产1t98%硫酸只需外界提供(或可向外界输出) 千焦能量;
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
查看答案和解析>>
科目:高中化学 来源:2011—2012学年辽宁省沈阳二中高二上学期10月月考化学试卷 题型:填空题
(12分)向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应
SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。
(1)点a-c段,速率变化的主要原因是 ,点c后速率变化的主要原因是 。
(2)c点是否已经达到平衡状态 (填“是”、“否”或“不一定”)
(3)反应物浓度:a点 b点(填“<”、“=”或“>”)
(4)反应物的总能量 生成物的总能量(填“<”、“=”或“>”)
(5)△t1=△t2时,SO2物质的量的变化量:a~b段 b~c段(填“<”、“=”或“>”)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省赣州市十二县高二上学期期中考试化学试卷(解析版) 题型:填空题
(1)已知红磷比白磷稳定,又知:4P(白磷,s)+5O2(g)=2P2O5(s) △H1;
4P(红磷,s)+5O2(g)=2P2O5(s) △H2,则ΔH1和ΔH2的关系是△H1 △H2(填“>”、“<”
或“=”)。
(2)已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1,写出由CO2
和H2生成液态甲醇和液态水的热化学方程式 。
(3)已知一定温度下,下列反应的平衡常数:SO2(g)+1/2O2(g) 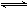 SO3(g)
K1,CO(g)+1/2O2(g)
SO3(g)
K1,CO(g)+1/2O2(g)
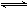 CO2(g)
K2。则相同温度下反应SO2(g)+CO2(g)
CO2(g)
K2。则相同温度下反应SO2(g)+CO2(g) 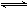 SO3(g)+CO(g)的平衡常数为
。
SO3(g)+CO(g)的平衡常数为
。
(用K1、K2表示)
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 2反应条件对化学反应的影响练习卷(解析版) 题型:选择题
反应SO2(g)+NO2(g)  NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是( )
A.平衡左移,容器内压强一定增大
B.平衡右移,达到平衡时容器压强一定增大
C.平衡不一定发生移动,容器内压强一定增大
D.平衡右移,SO2的转化率提高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com