
分析 (1)胆矾和碳酸氢钠两种固体物质要要充分接触才能充分反应,碱式碳酸铜受热易分解,生成黑色的氧化铜,硫酸铜与碳酸氢钠反应生成碱式碳酸铜,根据元素守恒书写化学方程式;
(2)碱式碳酸铜与甲酸反应生成甲酸铜,根据元素守恒书写化学方程式,甲酸铜的溶解度随温度的升高而变大,需趁热过滤,根据“相似相溶原理”可知甲酸铜易溶于水,难溶于有机溶剂.
解答 解:(1)a、胆矾和碳酸氢钠两种固体物质要要充分接触才能充分反应,所以研磨的作用是把药品研细并混合均匀,
故答案为:研细并混合均匀;
b、温度过高,Cu(OH)2•CuCO3会分解生成黑色的氧化铜,
故答案为:有黑色固体生成;
c、硫酸铜与碳酸氢钠反应生成碱式碳酸铜,根据元素守可知化学方程式为2CuSO4+4NaHCO3=Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O,
故答案为:2CuSO4+4NaHCO3=Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O;
(2)a、碱式碳酸铜与甲酸反应制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体,根据元素守可知化学方程式为Cu(OH)2•CuCO3+4HCOOH+5H2O=2Cu(HCOO)2•4H2O+CO2↑,
故答案为:Cu(OH)2•CuCO3+4HCOOH+5H2O=2Cu(HCOO)2•4H2O+CO2↑;
b、甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,
故答案为:防止甲酸铜晶体析出;
c、甲酸铜易溶于水,难溶于酒精,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的液体杂质,
故答案为:洗去晶体表面的水和其它杂质,减少甲酸铜的损失.
点评 本题考查了物质制备方案的设计,题目难度中等,明确制备原理为解答关键,注意掌握物质制备方案的设计原则,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数(25℃) | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO32-+2HClO | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 少量SO2通入Na2CO3溶液中:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| D. | 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向pH=13的NaOH溶液中不断加水稀释 | |
| B. |  向碳酸氢钠溶液中逐滴加入稀盐酸至过量 | |
| C. |  将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出 | |
| D. |  将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63.00 | B. | 63.60 | C. | 64.00 | D. | 65.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
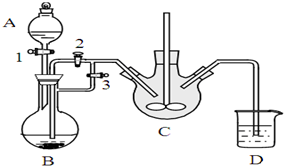 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热或光照时,浓HNO3更易发生分解 | |
| B. | 加催化剂,使氮气和氢气在一定条件下转化为氨气 | |
| C. | 可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,逆反应速率减小 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com