
��18�֣�1000mLij����Һ�г�����0.2 mol��L��1��Na���⣬�����ܺ������������е�һ�ֻ���֣�
������ | K+��NH4+��Fe3+��Ba2+ |
������ | Cl����Br����CO32����HCO3����SO32����SO42�� |
�ֽ�������ʵ������������Լ�����������
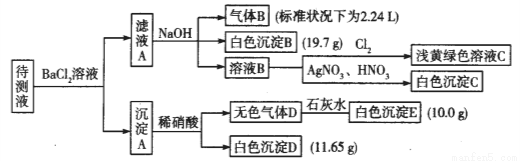
��1��д�����ɰ�ɫ����B�����ӷ���ʽ��___________________________________��
��2������Һ�п϶������ڵ���������_________________��
��3������ɫ����D�ǵ�һ���壺
�ٽ������ӵ����ʵ���Ũ�������±��У�һ�������ڵ��0��������ȷ�����?������
������ | Cl�� | Br�� | CO32�� | HCO3�� | SO32�� | SO42�� |
Ũ��/ mol��L��1 |
|
|
|
|
|
|
���ж�ԭ��Һ��K���Ƿ���ڣ������ڣ��������ʵ���Ũ�ȵ���Сֵ���������ڣ���˵�����ɣ�
________________________________________________________________��
��4������ɫ����D�ǻ�����壺
�ٴ���Һ��һ�����е���������____________________________��
�ڳ���A���ܻ�ԭϡ����ijɷ���______________________________��д��ѧʽ����
��18�֣�
��1��HCO3��+OH��+ Ba2+ = BaCO3��+H2O��2�֣�
��2��Fe3+��Ba2+��2�֣�
��3���٣�6�֣�
������ | Cl�� | Br�� | CO32�� | HCO3�� | SO32�� | SO42�� |
Ũ��/ mol��L��1 | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |
�ڴ��ڣ�1�֣���K�����ʵ���Ũ�ȵ���СֵΪ0.1 mol��L��1��2�֣�
��4����CO32����HCO3����SO32����3�֣�����BaSO3��2�֣�
��������
�������������Һ���Ȼ�����Һ��Ӧ�õ�����A������Һ�п��ܺ���CO32-��SO32-��SO42-��������м���ϡ�����������壬���в��ֳ������ܽ⣬˵����Һ�д���CO32-�����ܴ���SO32-��SO42-�е����ֻ�һ�֣��������ӹ����֪����Һ�в�����Ba2+����ҺA����Ba2+�����������NaOH��Һ�õ�����B����ɫ����B������Һ��һ������NH4+��HCO3-��HCO3-�������ӷ���˫ˮ�ⲻ�ܹ��棬����һ��������Fe3+������BΪNH3����ɫ����BΪBaCO3����ҺB��ͨ����������dz����ɫ��Һ����Һ��һ��û��Br-����ҺB�м�����������������Һ�õ���ɫ����C��CΪAgCl��˵����ҺB�к���Cl-�����ڼ����Ȼ�����Һ������ȷ��ԭ��Һ���Ƿ���Cl-��
��1��������������֪����ɫ����BΪ̼�ᱵ������HCO3-��Ba2+��OH-��Ӧ���ɣ���Ӧ���ӷ���ʽΪ�� HCO3-+Ba2++OH-=BaCO3��+H2O��
��2��������������֪����Һ��һ��û�е��������ǣ�Fe3+��Ba2+��
��3����������������֪������ȷ��ԭ��Һ���Ƿ���Cl-����Һ��һ��û��Br-��
����ɫ����D�ǵ�һ���壬˵������δ����ԭ����DΪCO2��EΪCaCO3����Һ�к���CO32-����ɫ����Dֻ��ΪBaSO4����Һ��һ��û��SO32-��һ������SO42-��n(BaCO3)=19.7g/197g/mol=0.1mol,��n��HCO3-��=0.1mol����c��HCO3-��=0.1mol/1L=0.1mol/L��n(CaCO3)==10g/100g/mol=0.1mol����n��CO32-��=0.1mol����c��CO32-��=0.1mol/1L=0.1mol/L��n(BaSO4)=11.65g/233g/mol=0.05mol����n��SO42-��=0.05mol����c��SO42-��=0.05mol/L�������𰸡�
��n��NH4+��=n��NH3��=2.24L/22.4L/mol=0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��c��HCO3-��=0.1mol/L��c��CO32-��=0.1mol/L��c��SO42-��=0.05mol/L�����ݵ���غ�ã�c��NH4+��+ c��Na+��=0.3mol/L<2 c��SO42-��+2 c��CO32-��+ c��HCO3-��=0.4mol/L����һ������K+������Һ��û��Cl-��K+����Ũ����С�� c��K+����СŨ��=0.4mol/L-0.3mol/L=0.1mol/L;
(4) ������������֪����Һ��һ������CO32-��HCO3-������ȷ��ԭ��Һ���Ƿ���Cl-����Һ��һ��û��Br-��
����ɫ����D�ǻ�����壬�������������ᷢ��������ԭ��Ӧ��ֻ����SO32-������Dֻ��ΪCO2��NO������壬��ɫ����Dֻ��ΪBaSO4����Һ��һ������SO32-������ȷ���Ƿ���SO42-������A��һ������BaCO3��BaSO3��
�ٴ���Һ��һ�����е���������CO32-��HCO3-��SO32-��
�ڳ���A��BaCO3��BaSO3����ϡ���ᷴӦ���ʴ�Ϊ��BaCO3��BaSO3��
���㣺�������ӵ��ƶϡ����飬����ʵ������з�Ӧ�������ӹ���������ȷ����Һ�д��ڵ����ӣ�����غ���ɵ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�γ��С��������и�һ��ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�ɢϵ�У���ɢ�����뾶��С����
A���� B��KCl��Һ
C�������� D������Cu(OH)2����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������һ�С�������ѧ�������ϵ��л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�Fe2(SO4)3��Һ��������ȷ����
A������Һ�У�K+��Fe2+��C6H5OH��Br�����Դ�������
B����KI��Һ��Ӧ�����ӷ���ʽ��Fe3+ + 2I�� Fe2+ + I2
Fe2+ + I2
C����Ba(OH)2��Һ��Ӧ�����ӷ���ʽ��Fe3+ + SO42�� + Ba2+ + 3OH�� Fe(OH)3��+ BaSO4��
Fe(OH)3��+ BaSO4��
D��1L0.1mol/����Һ��������Zn��ַ�Ӧ������11.2gFe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ̩���н������߶���ѧ���п��Ի�ѧ�Ծ���ѡ�ޣ��������棩 ���ͣ�ѡ����
��һ���¶��£��ݻ�������ܱ������з�����Ӧ��C(s)+H2O(g)  CO(g)+H2(g)���������������϶��ÿ��淴Ӧ�Ѿ��ﵽƽ��״̬����
CO(g)+H2(g)���������������϶��ÿ��淴Ӧ�Ѿ��ﵽƽ��״̬����
A���������ѹǿ���ٷ����仯
B����������������ٷ����仯
C����Ӧ��CO��H2�����ʵ���֮��Ϊ1�U1
D������nmol CO��ͬʱ����nmol H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ̩���н������߶���ѧ���п��Ի�ѧ�Ծ���ѡ�ޣ��������棩 ���ͣ�ѡ����
ͨ�����ƻ�ı䷴Ӧ�������Լӿ졢����������ֹ��Ӧ�Ľ��У�ʹ��ѧ��Ӧ��������������������������������и�ͼ��ʾ�Ĵ�ʩ�У���Ϊ�˼ӿ컯ѧ��Ӧ���ʵ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Fe2+��I����Br������Һ��ͨ��������������Һ�и������ӵ����ʵ����仯����ͼ��ʾ���й�˵������ȷ����

A���߶�BC����Fe3+ ���ʵ����ı仯���
B��ԭ�����Һ��n(FeBr2)��6mol
C����ͨ��Cl2 2molʱ����Һ���ѷ��������ӷ�Ӧ�ɱ�ʾΪ��
2Fe2++2I��+2Cl2��2Fe3++I2+4Cl��
D��ԭ��Һ��n(Fe2+): n(I��): n(Br��)��2:1:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ���������ֵ������˵����ȷ����
A��1 mol NaHSO4��������������Ϊ2NA
B��2.24 L 14CH4����������������Ϊ0.8NA
C��0.1 L 3 mol��L-1��NH4NO3��Һ�к��е�NH4+��ĿΪ0.3NA
D��1 mol Fe�������г��ȼ��ʧȥ�ĵ�����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������ѧ�ڵ�һ�ν��Լ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ��Ӧ�IJ����뷴Ӧ������ص���
A��AlCl3��NaOH B��C��O2 C��CO2��NaOH D��Fe��Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����ͬ������SO2��SO3��˵�����й�ϵ��ȷ���� �� )
A������ԭ�Ӹ�����Ϊ2��3 B������Ԫ��������Ϊ5��6
C������ԭ�Ӹ�����Ϊ5:4 D������Ԫ��������Ϊ4��5
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com