
| A. | 常温下,10 mL 0.2mol/L NH4NO3溶液与10 mL 0.1mol/L NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| B. | 0.1 mol/LNa2S溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| C. | 常温下a mL 0.1 mol/L KOH与b mL 0.1 mol/L HCN两溶液混合后pH>7,则有a≥b或a<b | |
| D. | 10 mL 0.1mol/L NaCl溶液中离子总数为x,10mL 0.1mol/L CH3COONa溶液中离子总数为y,则x>y |
分析 A、10 mL 0.2mol/L NH4NO3溶液与10 mL 0.1mol/L NaOH溶液混合后的溶液要从物料守恒和电荷守恒的角度进行分析其离子浓度;
B、0.1 mol/LNa2S溶液主要考查溶液的电荷守恒;
C、a mL 0.1 mol/L KOH与b mL 0.1 mol/L HCN两溶液混合后pH>7,是因为生成的盐的水解与酸的电离的比较;
D、主要考虑CH3COONa水解对溶液中离子浓度的影响.
解答 解:A、根据物料守恒,c(NO3-)=c(NH4+)+c(NH3•H2O)=2c(Na+),根据电荷守恒,c(NH4+)+c(Na+)+c(H+)=c(NO3-)+c(OH-),又知:pH=9.6,所以有c(NO3-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+),故A正确;
B、0.1 mol/LNa2S溶液中的电荷守恒为:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C、HCN是弱酸,如果a≥b则溶液pH>7,如果a<b,当水解大于电离时则有可能溶液pH>7,故C正确;
D、根据NaCl溶液的电荷守恒,c(Na+)+c(H+)=c(Cl-)+c(OH-),离子浓度为2c(Na+)+2c(H+); CH3COONa溶液中的电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),其离子总浓度为2c(Na+)+2c(H+),因为 NaCl溶液显中性c(OH-)=c(H+),CH3COONa溶液显碱性c(OH-)>c(H+),所以 NaCl溶液中离子总数为x大于 CH3COONa溶液中离子总数为y,故D正确;
故选B.
点评 本题是电解质溶液中的电荷守恒、物料守恒的考查,又涉及到不同电解质溶液的比较,难度较大.D选项是难点.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3、MgC12 | B. | NH4HCO3、AlC13 | C. | (NH4)2CO3、BaCl2 | D. | NH4HCO3、MgC12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③④⑤ | C. | ①③⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
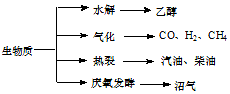 生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源,生物质的主要转化途径及主要产物如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| B. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com