
【题目】短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,其中W为无机非金属材料的主角,下列说法正确的是

A. W位于第三周期Ⅳ族
B. Y的气态氢化物分子中含极性共价键
C. X的最高价氧化物的电子式是![]()
D. 常温下不能用Z单质制成的容器盛放Y的最高价氧化物对应的水化物的浓溶液
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述正确的是( )。
A.离子晶体中只存在离子键
B.原子晶体中只存在共价键
C.金属晶体的熔沸点均很高
D.0族元素的单质形成的晶体为原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着碱金属元素原子序数的增大,下列递变规律错误的是( )
A.原子半径逐渐增大
B.最高价氧化物对应水化物的碱性逐渐增强
C.单质的熔、沸点逐渐升高
D.单质的还原性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】老鼠能在含饱和多氟碳化物的溶液内部获得氧气,像鱼儿一样在水中游动,另有实验表示,把狗身上的70%的血液,换成由25%的多氟碳化物和75%的水混合成的乳液后仍可存活,科学家预测多氟碳化物可能成为血液的替代品.全氟丙烷(C3F8)是一种常见的多氟碳化物,下列对该物质的叙述中正确的是
A. 全氟丙烷的电子式为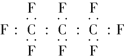 B. 原子半径C比F的小
B. 原子半径C比F的小
C. 全氟丙烷分子中的化学键只有共价键 D. 全氟丙烷分子中碳链成直线型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+,又含有Fe3+,将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质,0.425mol FeCl2 和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 该盐酸的物质的量浓度为4.25mol·L-1
B. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3∶1
C. 成的H2S气体在标准状况下的体积为2.24L
D. 该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:C(s)+![]() O2(g)=CO(g)ΔH =–110.4kJmol-1,
O2(g)=CO(g)ΔH =–110.4kJmol-1,

2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为________。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如右图所示。
①该反应的ΔH___0 (填“>”或“<”);600K时,Y点甲醇的v(正) ____v(逆)(填“>”或“<”)。
②从Y点到X点可采取的措施是___________________________________。
③在t1K时,向固定体积为2L的密闭容器中充入1molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)=_____________, 温度为t1时,该反应的平衡常数K=____________。
Ⅱ.金属铜因导电性强而应用广泛。
由黄铜矿冶炼得到的粗铜经过电解精炼才能得到纯铜。电解时,粗铜作______极,阴极的电极反应式为_______________。
Ⅲ.含铜离子的的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使铜离子的浓度符合排放标准(不超过0.5mg/L),溶液中的硫离子的物质的量浓度至少为__________mol/L(保留至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是

A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应
B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙可能是铜和稀硝酸
C. 若甲为硫磺燃烧产物,丁为水,则戊不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的沸点高于H2S是因为________________;H2O分子比H2S分子稳定是因为__________________。
(2)Al和铁红发生铝热反应的化学方程式_________________,该反应的用途是_________________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O![]() +O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. O2和S2O![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子数为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com