
【题目】锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
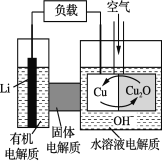
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
【答案】C
【解析】
放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为O2+4e-+2H2O=4OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答。
A.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,故A正确;
B.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,可以知道通空气时,铜被腐蚀,表面产生Cu2O,故B正确;
C.正极上氧气得电子生成氢氧根离子,则正极的电极反应式为O2+4e-+2H2O=4OH-,故C错误;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,得电子的物质是氧气,所以氧气为氧化剂,故D正确。
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m g氢气和n g氦气的下列说法中,正确的是
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比![]() >1
>1
D.同温同压下,H2与He的密度比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作进行的相应实验,能达到实验目的的是( )
A.用图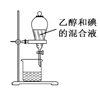 所示装置分离乙醇和碘的混合液
所示装置分离乙醇和碘的混合液
B.用图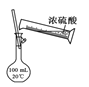 所示操作配制100 mL 0.1 mol·L-1硫酸溶液
所示操作配制100 mL 0.1 mol·L-1硫酸溶液
C.用图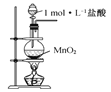 所示装置制取氯气
所示装置制取氯气
D.用图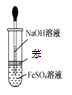 所示装置不能制取Fe(OH)2
所示装置不能制取Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧B. ①③④⑤
C. ①②③④⑤⑦D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂,某课外小组测定该补血剂中铁元素的含量.实验步骤如下::
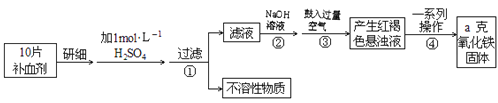
请回答下列问题:
(1)步骤②中加入足量NaOH发生的主要反应的离子方程式为______________。步骤③中反应的化学方程式为_____________________。
(2)步骤④中一系列处理的操作步骤:___________、洗涤、___________、冷却、称量.
(3)实验中需用98%浓硫酸(密度1.84g/mL)配制1mol/L的稀硫酸480mL,配制时用到的玻璃仪器除量筒、烧杯、胶头滴管、玻璃棒外还有___________,需用量筒量取浓硫酸________mL。
(4)若实验无损耗,则每片补血剂含铁元素的质量___________g(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含溴化氢的废液中提取溴单质,下列装置能达到实验目的的是( )
A.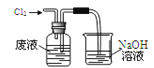 氧化废液中的溴化氢
氧化废液中的溴化氢
B.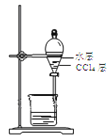 分离CCl4和水层
分离CCl4和水层
C.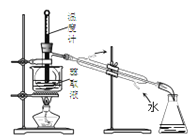 分离四氯化碳和液溴
分离四氯化碳和液溴
D.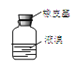 密封存放单质溴
密封存放单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液.某研究小组用该含碘废液制备NaI固体,实验流程如下:
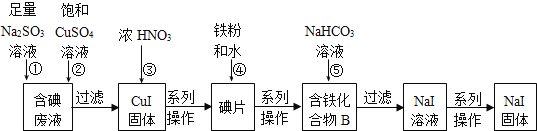
已知:反应②2I-+2Cu2++SO32-+H2O═2CuI↓+SO42-+2H+。回答下列问题:
(1)产生含碘废液的离子方程式为____________。
(2)①中I2与Na2SO3溶液反应的离子方程式为_________。
(3)化合物B中含两种元素,铁元素与另一种元素物质的量之比为3:8,则化合物B的化学式为____。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则⑤的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
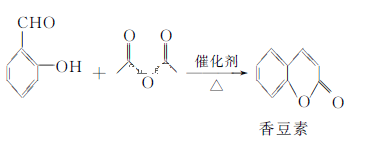
【题目】香豆素是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去):
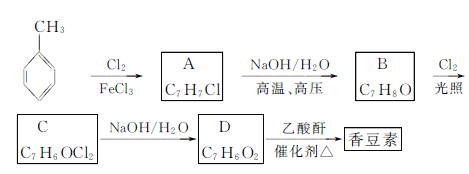
已知以下信息:
①A中有五种不同化学环境的氢;
②B可与FeCl3溶液发生显色反应;
③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题:
(1)香豆素的分子式为____________;
(2)由甲苯生成A的反应类型为________,A的化学名称为________;
(3)由B生成C的化学反应方程式为____________;
(4)B的同分异构体中含有苯环的还有________种,其中在核磁共振氢谱中只出现四组峰的有________种;
(5)D的同分异构体中含有苯环的还有________种,其中:
①既能发生银镜反应,又能发生水解反应的是____________(写结构简式);
②能够与饱和碳酸氢钠溶液反应放出CO2的是____________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com