
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe 3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:山东省兖州市2010-2011学年高一上学期期末考试化学试题 题型:013
|
全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2 | |
| [ ] | |
A. |
该反应中Cu2S只是还原剂 |
B. |
每生产1 mol Cu需转移2 mol电子 |
C. |
该反应中Cu2S既是氧化剂又是还原剂 |
D. |
若用该反应生产铜,全世界每年产生的SO2的体积(标准状况)约为1.4×106 L |
查看答案和解析>>
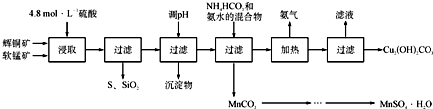
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe 3+ | 1.1 | 3.2 |
| Mn 2+ | 8.3 | 9.8 |
| Cu 2+ | 4.4 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
赤铜矿的主要成分是Cu2O,辉铜矿主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O ![]() 6Cu+SO2↑下列关于该反应的说法正确的是
6Cu+SO2↑下列关于该反应的说法正确的是
A.Cu2S在反应中既是氧化剂,又是还原剂
B.Cu既是氧化产物,又是还原产物
C.该反应中氧化剂只有Cu2O
D.每生成19.2g Cu,反应中转移0.6mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com