
”¾ĢāÄæ”æÄųļÓ£ØNi”ŖCd£©æɳäµēµē³ŲŌŚĻÖ“śÉś»īÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£ŅŃÖŖijÄųļÓµē³ŲµÄµē½āÖŹČÜŅŗĪŖKOHČÜŅŗ£¬Ęä³ä”¢·Åµē°“ĻĀŹ½½ųŠŠ£ŗCd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2”£ÓŠ¹ŲøƵē³ŲµÄĖµ·ØÕżČ·µÄŹĒ
Cd(OH)2 + 2Ni(OH)2”£ÓŠ¹ŲøƵē³ŲµÄĖµ·ØÕżČ·µÄŹĒ
A£®³äµēŹ±Ńō¼«·“Ó¦£ŗNi(OH)2 £e”Ŗ + OH- = NiOOH + H2O
B£®³äµē¹ż³ĢŹĒ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄܵĹż³Ģ
C£®·ÅµēŹ±øŗ¼«ø½½üČÜŅŗµÄ¼īŠŌ²»±ä
D£®·ÅµēŹ±µē½āÖŹČÜŅŗÖŠµÄOH-ĻņÕż¼«ŅʶÆ

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņŹĒÉśĪļ±ŲŠčµÄÓŖŃųŌŖĖŲÖ®Ņ»£¬ĻĀĮŠ¹ŲÓŚ×ŌČ»½ēÖŠĮņŃ»·(ČēĶ¼ĖłŹ¾)Ėµ·ØÕżČ·µÄŹĒ

A. ŗ¬ĮņøĖ¾ś¼°ŗĆŃõ/ŃįŃõ¾ś“Ł½ųĮĖĮņµÄŃ»·
B. ĮņŃ»·ÖŠĮņµÄ»ÆŗĻĪļ¾łĪŖĪŽ»śĪļ
C. ÉĻŹöĮņŃ»·ÖŠĮņŌŖĖŲ¾ł±»Ńõ»Æ
D. ÉÕĆŗŹ±¼ÓŹÆ»ŅŹÆ£¬æɼõÉŁĖįÓź¼°ĪĀŹŅĘųĢåµÄÅÅ·Å
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”泓¹ż²ĖµÄĢś¹ųĪ“¼°Ź±Ļ“¾»£Ø²ŠŅŗÖŠŗ¬NaCl£©£¬²»¾Ć±ć»įŅņ±»øÆŹ“¶ų³öĻÖŗģŗÖÉ«Šā°ß”£øÆŹ“ŌĄķČēÓŅĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. øÆŹ“¹ż³ĢÖŠ£¬øŗ¼«ŹĒC
B. FeŹ§Č„µē×Ó¾µē½āÖŹČÜŅŗ×ŖŅĘøųC
C. Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ4OHØD£4e£==2H2O£«O2”ü
D. ĆæÉś³É1molĢśŠā£ØFe2O3”¤xH2O£©ĄķĀŪÉĻĻūŗıź×¼×“æöĻĀµÄO233.6L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØµÄĪĀ¶ČĻĀ£¬ŌŚ¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ£¬²»ÄܱķŹ¾·“Ó¦X(Ęų)+2Y£ØĘų£©![]() 2Z(Ęų)Ņ»¶Ø“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ£Ø £©
2Z(Ęų)Ņ»¶Ø“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ£Ø £©
A. ČŻĘ÷ÄŚŃ¹Ēæ²»Ėꏱ¼äøıäB. ČŻĘ÷ÄŚ»ģŗĻĘųĢåµÄĆÜ¶Č²»Ėꏱ¼äøıä
C. Éś³ÉZµÄĖŁĀŹÓėÉś³ÉYµÄĖŁĀŹĻąµČD. »ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»Ėꏱ¼äøıä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶéĢžĻą¶Ō·Ö×ÓÖŹĮæĪŖ86£¬ČōøĆ·Ö×ÓÖŠ½öŗ¬ÓŠ3øö¼×»ł£Ø”ŖCH3£©£¬ŌņĘäŅ»ĀČČ”“śĪļ×ī¶ąÓŠ£Ø””””£©Ö֣ز»æ¼ĀĒĮ¢ĢåŅģ¹¹£©
A. 7 B. 8 C. 9 D. 10
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹŹōÓŚ·Ēµē½āÖŹµÄŹĒ
A. Įņ»ÆĒāĘųĢå B. H2O
C. ĮņĖįøĘ¹ĢĢå D. SO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ÖŠ¼×³ŲŹĒŅŌ¼×“¼ĪŖŌĮĻ£¬KOHĪŖµē½āÖŹµÄøߊ§Č¼ĮĻµē³Ų£¬µē»Æѧ¹ż³ĢµÄČēĶ¼”£
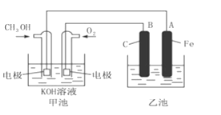
ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ
A. ¼×³ŲµÄ×Ü·“Ó¦Ź½ĪŖ£ŗ2CH3OH+3O2+4KOH== 2K2CO3+6H2O
B. ČōŅŅ³ŲÖŠĪŖ×ćĮæAgNO3ČÜŅŗ£¬ŌņŃō¼«µÄµē¼«·“Ó¦ĪŖ4OH--4e- = 2H2O+O2”ü
C. ČōŅŅ³ŲÖŠĪŖŅ»¶ØĮæCuSO4ČÜŅŗ,ĶصēŅ»¶ĪŹ±¼äŗó£¬ĻņĖłµĆµÄČÜŅŗÖŠ¼ÓČė0.1mol Cu(OH)2ŗóĒ”ŗĆ»Öø“µ½µē½āĒ°µÄÅضČŗĶpH,Ōņµē½ā¹ż³ĢÖŠ×ŖŅʵĵē×ÓŹżĪŖ0.2NA
D. ³£ĪĀ³£Ń¹ĻĀ£¬1 g CH3OHČ¼ĮĻÉś³ÉCO2ŗĶŅŗĢ¬H2OŹ±·ÅČČ22.68 kJ,±ķŹ¾øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖCH3OH(l)+1.5O2(g) ==CO2(g)+2H2O(l) ¦¤H= -725.80 kJ”¤mol-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×ČŻĘ÷ÖŠ½ųŠŠČēĻĀ·“Ó¦4A(s)+3B(g)![]() 2C(g)+D(g)£¬¾2 min,BµÄÅØ¶Č¼õÉŁ0.6 mol/L”£¶Ō“Ė·“Ó¦ĖŁĀŹµÄĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2C(g)+D(g)£¬¾2 min,BµÄÅØ¶Č¼õÉŁ0.6 mol/L”£¶Ō“Ė·“Ó¦ĖŁĀŹµÄĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ŌŚ2 minÄ©µÄ·“Ó¦ĖŁĀŹ£¬ÓĆB±ķŹ¾ŹĒ 0.3 mol/(L”¤min)
B. ÓĆA±ķŹ¾µÄ·“Ó¦ĖŁĀŹŹĒ0.4 mol/(L”¤min)
C. ČōŅŅČŻĘ÷ÖŠŅ²Ķ¬Ź±½ųŠŠ“Ė·“Ó¦£¬ĒŅĻąĶ¬Ź±¼ä¶ĪÄŚÓĆD±ķŹ¾µÄĖŁĀŹŹĒ0.2 mol/(Lmin)£¬ŌņŅŅČŻĘ÷ÖŠ·“Ó¦ĖŁĀŹøüæģ
D. ¶Ō¼×ČŻĘ÷ÉżøßĪĀ¶Č£¬ŌņÕż·“Ó¦ĖŁĀŹ½«¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµē¶Æ×ŌŠŠ³µÓÉÓŚĮé»ī”¢æģ½Ż”¢·½±ć£¬ŅŃ³ÉĪŖÉĻ°ą×åµÄÖ÷ŅŖ“ś²½¹¤¾ß£¬ĘäµēŌ“³£²ÉÓĆĒ¦Šīµē³Ų”£·“Ó¦ŌĄķ£ŗPb(s)£«PbO2(s)£«2H2SO4(aq) ![]() 2PbSO4(s)£«2H2O(l)”£øł¾Ż“Ė·“ӦŊ¶ĻĻĀĮŠŠšŹö“ķĪóµÄŹĒ( )
2PbSO4(s)£«2H2O(l)”£øł¾Ż“Ė·“ӦŊ¶ĻĻĀĮŠŠšŹö“ķĪóµÄŹĒ( )
A. ·ÅµēŹ±øŗ¼«·“Ó¦£ŗPb(s)£«SO42-(aq)£2e£ = PbSO4(s)B. ·ÅµēŹ±»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ
C. ·ÅµēŹ±£¬µē½āŅŗµÄĆܶČŌö“óD. ·ÅµēŹ±£¬Õżøŗ¼«ÖŹĮ涼Ōö¼Ó
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com