
(8分)提供下列四种试剂:①氢氧化钠溶液(质量分数为50%),②浓盐酸、③浓硫酸,取三种金属:铁片、铜片、铝片(表面用砂纸打磨过)做实验:
(1)若要证明三种金属的活动性强弱,可选用的试剂编号为
(2)室温下,将三种金属分别投入上述某种试剂中,均不能观察到明显的现象,试剂的编号是
(3)有一种试剂只能和上述三种金属中的一种发生化学反应,该试剂的编号是 ,
该反应的氧化剂是
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
具有防腐作用的甲醛
A.分子中共有12个电子 B.能发生加聚反应
C.难溶于水易溶于酒精 D.比例模型为: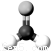
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:填空题
(10分)某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有______________(选填序号),还缺少的仪器有________(写仪器名称)。
(2)配制100 mL 1 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体________mL(保留一位小数),量取浓硫酸时应选用________(选填①10 mL、②50 mL、③100 mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是_________。
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
已知还原性Cl-< Br-<Fe2+<I-,下列反应不能发生的是
A.2Fe3++2I-=== 2Fe2++ I2 B.Cl2+2Br-=== 2 Cl-+ Br2
C.I2 + 2Cl- === 2I- + Cl2 D.2Fe2++Br2===2Fe3++2Br-
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
下列实验操作:①取液体试剂,②取固体试剂,③溶解,④过滤,⑤蒸发。一定要用到玻璃棒的是
A.①②③ B.②③④ C.①②⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.蒸发过程中必须用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗里下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
下列有关NaHCO3和Na2CO3性质的比较中,正确的是
A.热稳定性:Na2CO3<NaHCO3
B.常温时在水中的溶解度:Na2CO3<NaHCO3
C.等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3
D.等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.NaHCO3溶液:K+、Fe3+、SO42-、NO3-
D.Kw/c(H+)=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:填空题
(10分)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)  CH3OH (g) △H=-116kJ/mol
CH3OH (g) △H=-116kJ/mol
(1)该反应的化学平衡常数表达式为 ;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是 (填字母序号) 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号).
a.c ( H2 )减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c ( H2 )/ c (CH3OH )减小
(4)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图所示。
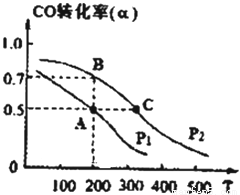
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA tC(填于“大于”、“小于”或“等于”)。
②若A点时容器的体积为1 L,该温度下B点的平衡常数K= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com