
【题目】在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是
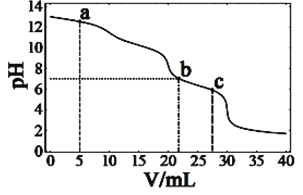
A. 在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B. 在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C. 在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D. 若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
【答案】B
【解析】
A.在a点是滴入5mL盐酸和氢氧化钠反应,溶液中剩余氢氧化钠5mL,碳酸钠溶液显碱性,据此分析判断离子浓度大小;
B.b点是加入盐酸,溶液pH=7呈中性,结合溶液中电荷守恒计算分析;
C.在c点的溶液pH<7,为碳酸氢钠、碳酸和氯化钠溶液,碳酸电离程度大于碳酸氢根离子水解;
D.溶液中存在电荷守恒分析判断。
A. 在a点是滴入5mL盐酸和氢氧化钠反应,溶液中剩余氢氧化钠5mL,碳酸钠溶液显碱性,溶液中离子浓度大小c(Na+ )>c(CO32-)>c(OH-)>c(C1-)>c(H+ ),故A错误;
B.b点溶液pH=7,溶液为氯化钠、碳酸氢钠和碳酸溶液,n(CO32-)<n(H2CO3),溶液中存在物料守恒,n(CO32-)+n(HCO3-)+n(H2CO3)=0.001mol,则2n(CO32-)+n(HCO3-)<0.001mol,所以B选项是正确的;
C.在c点的溶液pH<7,为碳酸氢钠、碳酸和氯化钠溶液,碳酸电离程度大于碳酸氢根离子水解,溶液显酸性,故C错误;
D.若将0.1 mol/L的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时,溶液中存在电荷守恒:c(Na+ )+c(H+ )=c(CH3COO-)+n(HCO3-)+c(OH-)+2c(CO32-),由于pH=7,c(H+ )= c(OH-),得到:c(Na+ ) =c(CH3COO-)+n(HCO3-)+2c(CO32-),即c(Na+ ) >c(CH3COO-),故D错误。
所以B选项是正确的。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x、y、z、w、n为五种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
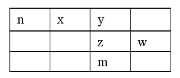
请回答下列问题:
(1)w位于周期表中第__________周期,第__________族。
(2)n、z、w、三种元素最高价氧化物水化物的酸性由弱到强的顺序为:__________(用化学式表示)。
(3)下列事实能说明y元素的非金属性比z元素的非金属性强的是____
A.y单质与z的气态氢化物水溶液反应,溶液变浑浊
B.在氧化还原反应中,1moly单质比1molz得电子多
C.y和z两元素的简单氢化物受热分解,前者的分解温度高
D.y元素最高价氧化物水化物酸性比z元素最高价氧化物水化物酸性强
(4)y和氢元素形成的10电子微粒中常见![]() 价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见
价阳离子为__________(填化学式);z和氢元素形成的18电子微粒中常见![]() 价阴离子的电子式为__________。
价阴离子的电子式为__________。
(5)化合物nyz存在于天然气中,可以用NaOH溶液洗涤除去。化合物nyz的电子式为__________,其与NaOH溶液反应除生成两种正盐外,还有水生成,其化学方程式为__________。
(6)m元素的原子序数为__________,它是一种__________。(填“金属”或“非金属”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金、银、铝、镁、钛,均是人类大量生产和使用的金属。试回答下列问题:
(1)一个原子有多级电离能,从电子排布特点判断第三电离能大小:Mg______Al(填大于或等于或小于)。
(2)钛被称为继铁、铝之后的第三金属。第四周期元素中,未成对电子数目与基态钛原子未成对电子数目相同元素还有__________种。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中的位置_______。
(4)Ag+与氨水形成的二氨合银离子空间构型是直线形,其中配位原子的杂化类型是______。
(5)四氯化钛是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体,能与水蒸气反应发烟,生成二氧化钛固体,可以做烟幕剂。四氯化钛中存在的化学键类型是_______,写出上述反应的化学方程式____________________。
(6)工业用电解氯化镁制得镁,而不用氧化镁的原因___________________________。
(7)金单质的晶胞是面心立方结构,已知金相对原子质量为M,晶胞边长为d cm,则一个该晶胞占有的原子总质量为________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
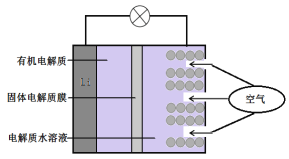
A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加热才能发生的反应一定是吸热反应
B.化学反应的热效应的大小与参加反应的物质的多少无关
C.反应物的总能量大于生成物的总能量的反应一定是放热反应
D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验. 实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验
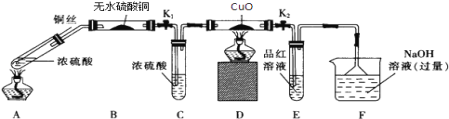
(1)A装置的试管中发生反应的化学方程式是________________________________;F装置的作用是______________________;B装置中的现象是_________________________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是:D装置中____________,E装置中_________________________。
(3)实验结束时,应先_________,再关闭K1 , K2,然后撤去所有酒精灯。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子,需将溶液稀释,操作方法是___________________________________________。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为a H2SO4+bCu ![]() cCu2S+dCuSO4+e H2O,则a:b=_________________。
cCu2S+dCuSO4+e H2O,则a:b=_________________。
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00mL 0.30molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为9.6g,则硫酸铜的产率为_____________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)(注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com