
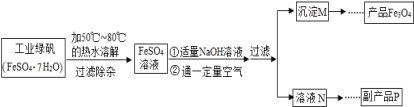
【题目】同学们对四氧化三铁产生了兴趣,从参考资料中找到氧化沉淀法生产复印用高档四氧化三铁粉的工艺流程简图。
[生产流程]
[查阅资料]
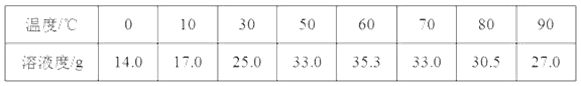
资料一:硫酸亚铁在不同温度下的溶解度如下表所示:
资料二:氢氧化亚铁受氧气氧化反应原理为4Fe(OH)2+2H2O+O2=4Fe(OH)3
资料三:获得四氧化三铁的反应原理为Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是______________。
(2)写出加入适量氢氧化钠溶液时发生反应的化学方程式_____________。
(3)上述过程中,要控制“通一定量空气”的目的是____________。
(4)要使四氧化三铁的产率最高,则上述流程中产生的氢氧化亚铁和氢氧化铁的最佳质量比为___。
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→______→______→d。
a.过滤b.加热浓缩c.冷却结晶d.晶体加热至完全失去结晶水
【答案】在50 ℃~80 ℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率 2NaOH+FeSO4=Fe(OH)2↓+Na2SO4 防止氢氧化亚铁完全转化为氢氧化铁 90∶214(或45∶107) c a
【解析】
根据工艺流程图及题干信息中温度与溶解度间的关系分析解答;根据物质信息分析书写相关反应方程式;根据硫酸钠的物理性质分析从溶液中得到硫酸钠的操作顺序。
(1)根据图表中的信息可知,在50 ℃至80℃的热水中,硫酸亚铁的溶解度较大,利于溶解更多的硫酸亚铁,提高产率,故答案为:在50 ℃~80 ℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率;
(2)氢氧化钠和硫酸亚铁反应生成氢氧化亚铁和硫酸钠,反应方程式为:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4;
(3)上述过程中,要控制“通一定量空气”的目的是控制氢氧化亚铁转化为氢氧化铁的量,故答案为:防止氢氧化亚铁完全转化为氢氧化铁;
(4)要使四氧化三铁的产率最高,上述流程中产生的氢氧化亚铁与氢氧化铁的物质的量之比为1∶2,最佳质量比为90∶214(或45∶107);
(5)根据硫酸钠晶体的溶解度随温度的升高而增大,采用加热浓缩、冷却结晶的方法,再过滤,晶体加热至完全失去结晶水,得到硫酸钠,故答案为:c;a。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)一种镍催化法生产GaN的工艺如图:
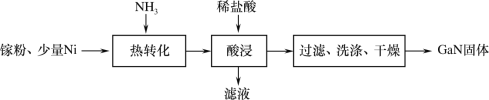
①镓(Ga)的原子结构示意图为![]() ,镓元素在周期表中的位置是___。
,镓元素在周期表中的位置是___。
②“热转化”时Ga转化为GaN的化学方程式是___。
③“酸浸”操作目的是___。
(2)某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
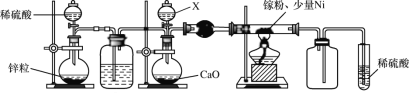
①仪器X中的试剂是__,加热前需先通入一段时间的H2,原因是__。
②取某GaN样品m克溶于足量热NaOH溶液,发生反应GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO3溶液将产生
GaO2-+NH3↑,用H3BO3溶液将产生![]() NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙酸的性质回答下列问题:
(1)将醋酸钠晶体与浓硫酸共热,可观察到的现象为___________;反应的化学方程式为________。
(2)在滴有酚酞的氢氧化钠溶液中,逐滴加乙酸至过量,现象为_______;反应的离子方程式为_______。
(3)在碳酸钠溶液中,加入乙酸后,有________放出,反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸特性的叙述不正确的是
A. 浓硫酸具有吸水性、脱水性和强氧化性等特性
B. 浓硫酸能吸收气体中的水蒸气,常作氨气、二氧化硫等气体的干燥剂
C. 浓硫酸可以吸收固体中的湿存水、结晶水合物中的结晶水
D. 在反应C12H22O11![]() 12C+11H2O,浓硫酸作脱水剂
12C+11H2O,浓硫酸作脱水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,氯元素的原子核外有____种不同运动状态的电子;有___种不同能级的电子,基态Fe3+的电子排布式为___。
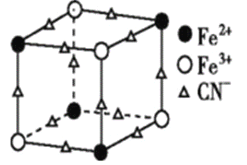
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是____;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如图所示(K+未画出),则一个晶胞中的K+个数为 ___。
结构如图所示(K+未画出),则一个晶胞中的K+个数为 ___。
(3)Cu2+能与乙二胺(H2N-CH2-CH2-NH2)形成配离子。该配离子中含有的化学键类型有 __ (填字母)
a.配位键 b.极性键 c.离子键 d.非极性键,
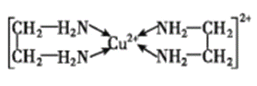
乙二胺中共有____个σ键,C原子的杂化方式为 ___。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3,则铜原子的直径约为____pm。
(5)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。回答下列问题。某化合物的化学式为Na3CrO8,其阴离子结构可表示为![]() ,则Cr的化合价为____。CrO42-呈四面体构型,结构为
,则Cr的化合价为____。CrO42-呈四面体构型,结构为![]() ,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为
,Cr2O72-由两个CrO42-四面体组成,这两个CrO42-四面体通过共用一个顶角氧原子彼此连接,结构为![]() 。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为____。
。则由n(n>1)个CrO42-通过顶角氧原子连续的链式结构的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,曾经挽救了数百万人的生命,近日获得诺贝尔生理与医学奖,成为我国获得诺贝尔科学奖的第一人。下列关于青蒿素的叙述错误的是( )
A. 青蒿素的一个分子中含有42个原子
B. 青蒿素中碳元素的质量分数约为63.8%
C. 青蒿素的相对分子质量为282
D. 0.1 mol青蒿素的质量为28.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、![]() 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是
等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是
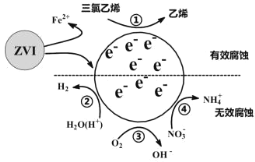
A.反应①②③④均在正极发生
B.④的电极反应式为![]() +10H++8e-=
+10H++8e-=![]() +3H2O
+3H2O
C.单位时间内,三氯乙烯脱去amolCl时ne=amol
D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市为了减少燃煤造成的大气污染,对民用燃料煤进行了多方面的改进。
(1)为了除去煤中的含硫化合物,可采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反应:FeS2+14FeCl3+8H2O=2FeSO4+13FeCl2+16HCl。为了充分利用Fe2+并减少HCl污染,可利用工业废铁屑和氯气与废液重新作用生成FeCl3的方法。请写出这一过程中有关的离子方程式:___________________________________。
(2)另一种方法是采用固硫法,即在燃煤中加入生石灰,使含硫煤在燃烧时生成的SO2不能逸出而进入炉渣中,试用化学方程式表示这一“固硫”过程:_______________________________。
(3)某城市采用了以油制气代替煤作民用燃料的做法。油制气的主要成分是丙烷,写出其燃烧的化学方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com