
用惰性电极电解400 mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,如果向所得的溶液中加入0.05 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和体积(不考虑CO2的溶解),电解过程中转移的电子物质的量为( )
A.0.2 mol
B. 0.3mol
C. 0.4 mol
D. 0.6 mol
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
用洁净的铂丝蘸取某种无色溶液,在无色火焰上灼烧,火焰呈黄色,说明该溶液中( )
A.只有Na+ B.可能有Na+,可能有K+
C.一定有K+ D.一定有Na+,也可能有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
将5 mol/L的盐酸10 mL稀释到200 mL,从中取出5 mL,这5 mL溶液的物质的量浓度为( )
A.0.5 mol/L B.0.25 mol/L C.0.1 mol/L D.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
利用低温技术可处理废气中的氮氧化物。在恒容密闭容器中发生下列化学反应:
4NH3(g)+6NO(g)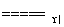 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
ΔH=Q kJ/mol(Q<0)。下列有关说法正确的是 ( )。
A.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中NO的转化率减小
C.单位时间内生成NH3和H2O的物质的量之比为2∶3时,反应达到平衡
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。
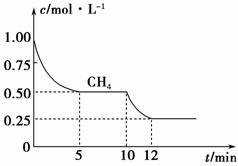
图1
反应进行的前5 min内,v(H2)=________;10 min时,改变的外界条件可能是______________________________________________________________。
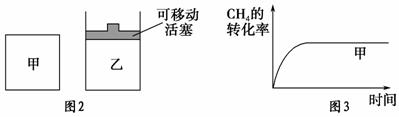
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。
(3)反应③中ΔH3=________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是________(填代号)。
a.v正>v逆 B.v正<v逆
c.v正=v逆 D.无法判断
(4)用该合成气制取甲醚的化学方程式为______________________________。
该反应的原子利用率为________(设反应完全进行,用质量百分比表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A.2.0mol·L-1 B.1.5 mol·L-1 C.0.18 mol·L-1 D.0.24 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
1840年,俄国化学家盖斯从大量实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出XkJ热量。已知单质碳的燃烧热为YkJ/mol,则1mol C与O2反应生成CO的反应热ΔH为 ( )
A.-YkJ/mol B.-(10X-Y)kJ/mol
C.-(5X-0.5Y)kJ/mol D.+(10X-Y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间的含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列有关“水”电池在海水中放电时的说法正确的是 ( )。
A.正极反应:Ag+Cl--e-===AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。

(1)a电极材料为__________,其电极反应式为__________。
(2)电解液d可以是__________,则白色沉淀在电极上生成;也可以是__________,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液
C. NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是__________,在加入苯之前,对d溶液进行加热处理的目的是_______________________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com