
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度
C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度。假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小
D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
生活离不开化学,下列做法不合适的是
A.用白醋清洗热水瓶中的水垢
B.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
C.用铝锅长时间存放剩菜
D.利用激光笔区别鸡蛋白溶液和浓盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁实验步骤如下:
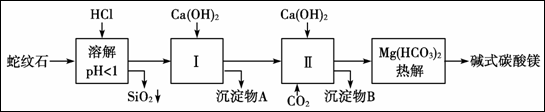
已知:
| 氢氧化物 | Fe(OH) 3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的阳离子有 。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致 溶解、 沉淀。
(3)物质循环使用,能节约资上述实验中,可以循环使用的物质是 。
(4)高温煅烧碱式碳酸镁aMgCO3·bMg(OH)2·cH2O得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式为 。(写出计算过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B.CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C.Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2
D.25 ℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于难溶物之间转化的说法中错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于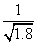 ×10-11 mol·L-1
×10-11 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO | ≤23 000 | ≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为____________mg·
L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),________(填“符合”或“不符合”)国家环保标准
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol·L-1 HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
A.c(H+)>c(F-) B.c(H+)>c(HF)
C.c(OH-)<c(HF) D.c(HF)>c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)DIS数字化信息系统因为可以准确测量溶液的pH而在中和滴定的研究中应用越来越广泛深入。某学习小组利用DIS系统测定NaOH滴定同浓度HCl、CH3COOH的pH变化曲线分别如下,你能从中得到的信息有(写出2条信息):
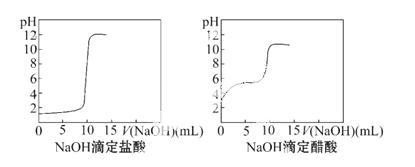
① _______________________________________________;
② _____ __________________________________________。
__________________________________________。
(2) 已知NO2和N2
已知NO2和N2 O4可以相互转化:2NO2(g)
O4可以相互转化:2NO2(g) N
N 2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
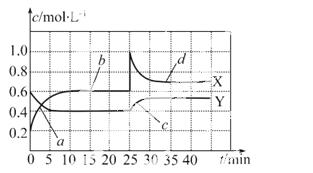
①图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 __________________。
②前10 min内用NO2表示的化学反 应速率v(NO2)= m
应速率v(NO2)= m ol·L-1·min-1;反应进行至25 min时,曲线发生变化的原因是 ____________________________。
ol·L-1·min-1;反应进行至25 min时,曲线发生变化的原因是 ____________________________。
③若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是 __。
A.加入催化剂 B.缩小容器 体积
体积
C.升高温度 D.加入一定量的N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com