
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | a.溶液pH=8 | i.S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 | ii.S2O32一+2H+=S↓+SO2↑ +H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
分析 实验探究:A.检验溶液酸碱性,用pH试纸进行测定;
i钠盐溶液显碱性,说明硫代硫酸根离子水解;
B.硫酸和硫代硫酸钠反应生成二氧化硫和硫单质;
C.氯水和硫代硫酸钠反应氯水褪色变浅说明氯气发生反应表现氧化性把硫代硫酸钠氧化为硫酸钠;
实验结论:由性质和现象说明硫代硫酸钠具有还原性和在溶液中水解显碱性;
问题讨论:氯水过量溶液中含有氯离子,干扰还原产物的检验.
解答 解:实验探究:A.由题干实验探究①的目的是测定溶液的PH,方法为用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照,
ⅰ.测定溶液PH=8说明溶液呈碱性,证明硫代硫酸跟离子水解显碱性,反应的离子方程式为:S2O32-+H2O?HS2O3-+OH-,
B.向pH=2的硫酸中滴加Na2S2O3溶液,发生反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O所以反应现象为:有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生,
ⅲ.向新制氯水(pH<2)中滴加少量Na2S2O3溶液,氯水和硫代硫酸钠反应氯水褪色变浅说明氯气发生反应表现氧化性把硫代硫酸钠氧化为硫酸钠,反应的离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,
故答案为:用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照;S2O32-+H2O?HS2O3-+OH-;有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生;S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
实验结论:由上述实验及现象可知,探究①为Na2S2O3呈碱性,能与强酸反应,探究②为具有还原性,
故答案为:Na2S2O3呈碱性,能与强酸反应;具有还原性;
问题讨论:探究②是向新制氯水(pH<2)中滴加少量Na2S2O3溶液,氯水过量溶液中一定有氯离子,加入硝酸银生成沉淀不能证明是氯气做氧化剂生成的,所以方案不正确;
故答案为:不正确;因氯水过量,氯水中同样含有Cl-.
点评 本题考查性质实验方案的设计,为高频考点,把握盐类水解、氧化还原反应及离子检验等为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①②③④⑤ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
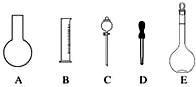 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同位素 | B. | O2和O3的相互转化是化学变化 | ||
| C. | O3是由3个氧原子构成的化合物 | D. | 等质量O2和O3含有的质子数不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:3 | C. | 3:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
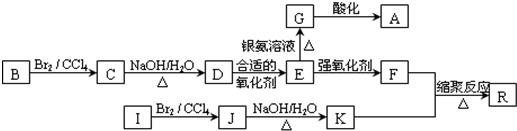

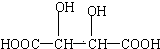 ;
;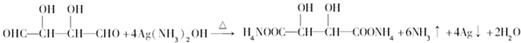 ;
;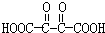 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$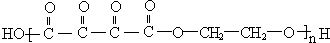 +(2n-1)H2O;
+(2n-1)H2O;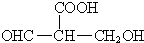 或
或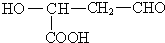 或
或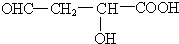 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3:1 | B. | 4:5 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com