
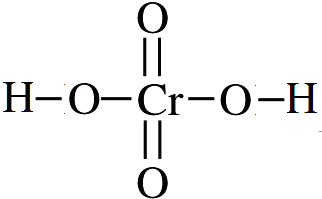
 .
.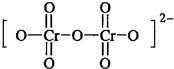
分析 (1)根据原子的价电子排布分析;
(2)元素的非金属性越强,其电负性越强;
(3)根据C原子的价层电子对数判断;根据CrO3中Cr原子的价层电子对数为判断;
(4)C2H5OH转化为时CH3CHO,C2H5OH中的一个C-H键和一个O-H断裂;
(5)分子间形成氢键的沸点较高;
(6)同族元素的价电子数相同;
(7)根据铬酸根离子的化学式和结构式来判断铬酸的结构式;
(8))①[Cr(H2O)5Cl]2+中Cr3+的配位数是6,H2O中含有2个共价键;
②溶液中非金属元素之间存在共价键、含有孤电子对和含有空轨道的原子之间存在配位键、分子之间存在范德华力.
解答 解:(1)Cr元素原子的价电子排布为3d54s1,含有6个未成对电子,未成对电子数最多,在周期表中位于第四周期第VIB族;
故答案为:第四周期第VIB族;
(2)元素的非金属性越强,其电负性越强,非金属性:H<C<S<O,则电负性:H<C<S<O;
故答案为:H<C<S<O;
(3)CH3CHO中全部以单键连接C原子的价层电子对数为4,属于sp3杂化,存在C=O中的C原子的价层电子对数为3,属于sp2杂化,所以C原子有2中杂化类型;CrO3中Cr原子的价层电子对数为3,属于sp2杂化,其空间构型为平面三角形;
故答案为:2;平面三角形;
(4)C2H5OH转化为时CH3CHO,C2H5OH中的一个C-H键和一个O-H断裂,则生成1mol CH3CHO,C2H5OH发生反应断裂σ键为2mol,其数目为2NA;
故答案为:2NA;
(5)氢键的作用力大于范德华力,则分子间形成氢键的沸点较高,C2H5OH分子间存在氢键,而CH3CHO分子间不能形成氢键,所以乙醇的沸点比乙醛的高;
故答案为:二者都是分子晶体,C2H5OH分子间可以形成氢键,而CH3CHO分子则不能;
(6)同族元素的价电子数相同,已知Cr元素原子的价电子排布为3d54s1,则Mo元素原子的价电子排布为4d55s1;
故答案为:4d55s1;
(7)已知铬酸根(CrO42-)的结构式为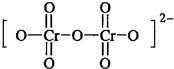 ,铬酸电离出2个氢离子即得到铬酸根离子,则铬酸的化学式为H2CrO4,其结构式为
,铬酸电离出2个氢离子即得到铬酸根离子,则铬酸的化学式为H2CrO4,其结构式为 ;
;
故答案为: ;
;
(8)①[Cr(H2O)5Cl]2+中Cr3+的配位数是6,H2O中含有2个共价键,所以该微粒中共含有6个配位键和10个共价键,则含有σ键的数目为16;
故答案为:16;
②A.水分子间存在氢键,故A不选;
B.水分子或[Cr(H2O)5Cl]2+中,非金属元素之间都存在共价键,故B不选;
C.金属单质中存在金属键,该溶液中不存在金属键,故C选;
D.[Cr(H2O)5Cl]2+中Cr原子和水分子中的O原子之间存在配位键,故D不选;
E.溶液中水分子之间存在范德华力,故E不选;
故答案为:C..
点评 本题考查比较综合,涉及元素在周期表中位置的判断、电负性的比较、杂化类型的判断、共价键、氢键、电子排布、结构式等,侧重于考查学生对基础知识的综合应用能力,题目难度中等,注意相关知识的积累.


科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体中分散质粒子直径大小在1~100 nm之间 | |
| B. | 可以利用丁达尔效应区分胶体和溶液 | |
| C. | 可利用过滤的方法分离胶体和溶液 | |
| D. | 胶体在一定条件下可以稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
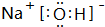 ,其中存在的化学键类型为离子键、共价键.
,其中存在的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Al3+、F-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ne | D. | Mg2+、Na+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
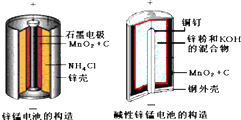
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: | |
| B. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的结构示意图: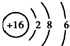 | |
| D. | O原子的基态电子排布式为:1s22s22p${\;}_{x}^{2}$p${\;}_{y}^{2}$p${\;}_{z}^{0}$. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com