
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 微热 |

| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

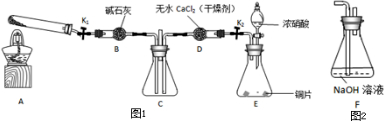
Ⅰ.(1)实验开始时先打开活塞K持续通入N2一段时间后,并闭K。将铜丝(足量)下移伸入浓硝酸后,有大量的红棕色气体生成,随时间的进行,气体颜色逐渐变浅,当A中充满无色气体时:
①装置A中反应的离子方程式为___________________________。
②接下来的实验操作是___________________________________。
(2)本实验中装置A的优点是____________________________。
Ⅱ.将B中所得溶液稀释至200 mL,用0.20 mol/L的NaOH溶液进行滴定。实验数据如下(硝酸的挥发分解及溶液体积的变化忽略不计):
实验编号 | 待测液体积(mL) | NaOH溶液体积(mL) |
1 | 20.00 | 15.98 |
2 | 20.00 | 14.99 |
3 | 20.00 | 15.01 |
(1)待测液的浓度为____________mol/L。
(2)硝酸与铜反应主要生成NO时硝酸的浓度不大于____________mol/L。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年云南省高三第二次复习统一检测(理综)化学部分 题型:实验题
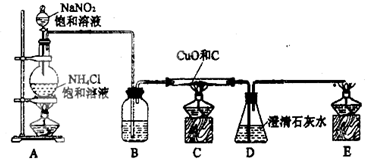
过碳酸钠(2Na2CO3·3H2O2)是一种多用途的新型消毒剂,可有效杀灭“甲型 H1N1流感”病毒。已知过碳酸钠是一种可溶于水的白色细小颗粒状粉末,50℃可分解,其3%的水溶液的pH约为10.5,过碳酸钠具有Na2C03和H202的双重性质。
(1)为探究过碳酸钠的性质,某同学用试管取适量过碳酸钠溶液,滴加酚酞试液。开始可能观察到的现象是 ,产生此现象的原因是 (用离子方程式表示),微热并振荡试管后又可能观察到 现象。
(2)已知过碳酸钠遇稀硫酸可产生两种气体。某化学课外活动小组利用以下装置完成了系列实验。

请回答下列问题:
①甲同学用装置I验证产生的两种气体,B中盛有足量的Ba(OH)2溶液,若观察到的现象是 ,则证明有 气体生成;简述验证另一种气体的方法 ;
②乙侧学把上述装置组合,用于测定2Na2CO3·3H2O样品中Na2CO3的含量。按气流从左到右的方向,装置I、II、III的连接顺序是 (填装置序号); B、E中应分别盛放 、 ;装置III中通空气的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com