
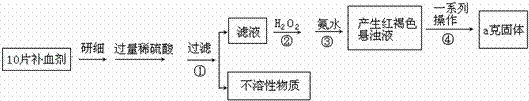
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加 ,该过程的现象为
(2)步骤②加入过量H2O2的目的是 .
(3)步骤③中反应的离子方程式是
(4)步骤④中一系列处理的操作步骤: 、洗涤、灼烧、冷却、称量.
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为 g.
考点:探究物质的组成或测量物质的含量.
专题:实验探究和数据处理题.
分析:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显血红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+.检验Fe2+可以先滴加KSCN溶液,溶液不变色,再滴加氯水或双氧水,溶液变为血红色,说明含有Fe2+;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,铁离子和氨水反应生成氢氧化铁和铵根离子;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(5)根据铁元素守恒可知ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,据此计算.
解答: 解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在,可以加入氧化剂将Fe2+氧化为Fe3+检验Fe2+,可以先滴加KSCN溶液,溶液不变色,加入氯水(或双氧水、稀硝酸),发生2Fe2++Cl2═2Fe3++2Cl﹣,溶液变为血红色,发生Fe3++3SCN﹣⇌Fe(SCN)3,说明含有Fe2+,
故答案为:氯水(或双氧水、稀硝酸);溶液开始不变色,后变为血红色;
(2)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,2H++H2O2+2Fe2+=2Fe3++2H2O,故答案为:将Fe2+全部氧化为Fe3+;
(3)步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水,反应离子方程式为Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,
故答案为:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+;
(4)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;洗涤;
(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量 =0.07ag,故答案为:0.07a.
=0.07ag,故答案为:0.07a.
点评:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:
下列各组表述中,两个微粒不属于同种元素原子的是( )
|
| A. | 3p能级有一个空轨道的基态原子和核外电子的排布 为1s22s22p63s23p2的原子 |
|
| B. | 2p能级无空轨道且有一个未成对电子的基态原子和原子的最外层电子排为2s22p5的原子 |
|
| C. | M层全充满而N层为4s2的原子和核外电子排布为 1s22s22p63s23p64s2的原子 |
|
| D. | 最外层电子数是核外电子总数的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 乙醛分子中的所有原子都在同一平面上 |
|
| B. | 凡是能发生银镜反应的有机物都是醛 |
|
| C. | 醛类既能被氧化为羧酸,又能被还原为醇 |
|
| D. | 完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下述三个实验均能发生化学反应.
① ② ③
将铁钉放入硫酸铜溶液中 向硫酸亚铁溶液中滴入几滴浓硝酸 将铁钉放入氯化铁溶液中
下列判断正确的是( )
A.实验①和③中的铁钉只做还原剂
B.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
C.实验②中Fe2+既显氧化性又显还原性
D.实验③中反应的离子方程式为:Fe+Fe3+═2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解
B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
C.浓硝酸与木炭反应的离子方程式:C+4H++4NO3﹣=CO2↑+4NO2↑+2H2O
D.HNO3→NO→NO2,以上各步变化均能通过一步实现
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,颜色的变化与氧化还原反应有关的是 ( )
A.往紫色石蕊试液中加入盐酸,溶液变红 B.饱和FeCl3溶液在沸水中变成红褐色胶体
C.向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色
D.SO2使滴有酚酞的NaOH溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或事实可用同一原理解释的是 ( )
A. 浓硫酸和浓盐酸长期暴露在空气中浓度降低
B. SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
C. 漂白粉、活性炭、Na2O2都能使红墨水褪色
D. 亚硫酸钠溶液和氯化铝溶液在空气中蒸干不能得到对应的溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、NH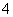 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO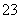 、SO
、SO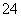 、NO
、NO 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是 ( )
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是 ( )
 A.溶液中的阳离子只有H+、Mg2+、Al3+
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中n(NH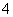 )=0.2 mol
)=0.2 mol
C.溶液中一定不含CO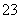 ,可能含有SO
,可能含有SO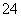 和NO
和NO
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com