
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为 ___ _____(填字母)。
(3) 常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)
A.[H+] B.[H+]/[CH3COOH] C.[H+]·[OH-] D.[OH-]/[H+]
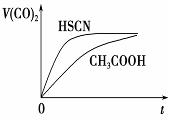 (4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是
(4)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20mL0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
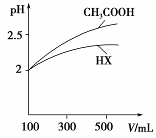 (5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(6)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确值),
c(CH3COO-)/c(CH3COOH)=________。
(7) 写出少量CO2通入次氯酸钠溶液中的离子方程式:
______________________________________________________________。
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请完成并配平以下化学方程式:
□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+□ 。
若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
(5)在微生物作用的条件下, NH4+经过两步反应被氧化成NO3ˉ。两步反应的能量变化示意图如下:
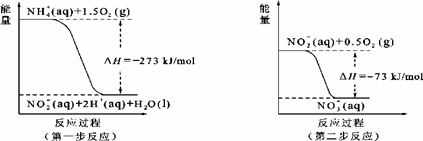
①第一步反应是 反应(填“放热”或“吸热”),
② 1mol NH4+(aq)全部氧化成NO3ˉ(aq)的热化学方程式是:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据陈述的知识,类推得出的结论正确的是
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B.已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3
C.已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S
D.已知Ca(HCO3)2 +2NaOH(过量) = CaCO3↓+ Na2CO3+ 2H2O,则
Mg (HCO3)2 +2NaOH(过量) = MgCO3↓+ Na2CO3+ 2H2O
(HCO3)2 +2NaOH(过量) = MgCO3↓+ Na2CO3+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列离子浓度的关系正确的是 ( )
A.pH=2的盐酸与pH=12的氨水等体积混合:
c(NH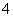 )=c(Cl-)>c(H+)=c(OH-)
)=c(Cl-)>c(H+)=c(OH-)
B.0.2 mol·L-1的CH3COONa溶液与0.1 mol·L-1的HCl等体积混合:
c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
C.0.1 mol·L-1的HCN(弱酸)和0.1 mol·L-1的NaCN等体积混合:
c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+)
D.相同物质的量浓度时,溶液中c(NH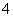 )由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O
)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有下列4种溶液,下列说法正确的是 ( )
| ① | ② | ③ | ④ |
| 0.1 mol·L-1 CH3COOH溶液 | pH=3 CH3COOH溶液 | 0.1 mol ·L-1 NaOH溶液 | pH=11 NaOH溶液 |
A.由水电离出的c(H+):③>①
B.①稀释到原来的100倍后,pH与②相同
C.①与③混合,若溶液pH=7,则两种溶液的体积:③>①
D.②与④混合,若溶液pH=7,则两种溶液的体积:④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
以下反应可以用熵判据来解释的是
A.硫酸铜饱和溶液降低温度时有晶体析出
B.(NH4)2CO3(s)==NH4HCO3(s)+NH3(g) △H=+74.9kJ/mol
C.CaO(s)+CO2(g)==CaCO3(s) △H=-175.7kJ/mol
D.2H2(g)+O2(g) ==2H2O(l) △H=-285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将2mol SO2和2mol SO3气体混合于固定容积的容器内,在一定条件下,发生反应:
2SO2 + O2 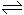 2SO3,达平衡时SO3为n mol。相同温度下分别按下列配比,平衡后SO3的物质的量大于n mol的是
2SO3,达平衡时SO3为n mol。相同温度下分别按下列配比,平衡后SO3的物质的量大于n mol的是
A.2mol SO2和1mol O2 B.2mol SO2和1mol O2和2mol SO3
C.4mol SO2和1mol O2 D.3mol SO2和0.5mol O2和1mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) 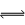 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
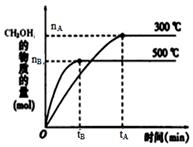 (1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(2)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
a.v消耗(CH3OH)=2 v消耗(H2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO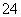 的数目相同,则所取两溶液的体积比是( )
的数目相同,则所取两溶液的体积比是( )
A.1∶3 B.3∶1
C.3∶2 D.2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com