
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的相对分子质量为( )
A.28 B.60 C.32 D.4
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
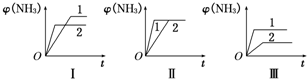
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.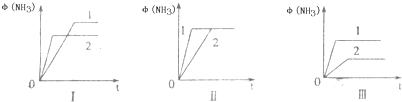
 H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
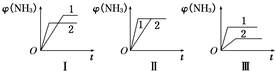 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:
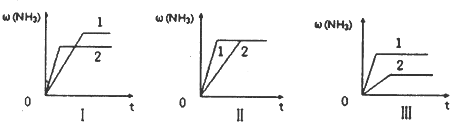
查看答案和解析>>
科目:高中化学 来源: 题型:
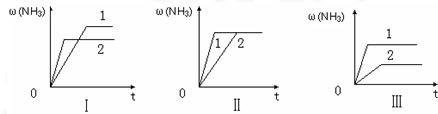
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com