
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.离子半径:r(Y2-)>r(Z2+)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物弱
D.X、Y、Z、W所有元素的最高正价等于其所在族的族序数
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是

A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同
D.甲中溶液的pH逐渐升高,丙中溶液的pH逐渐降低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市高三四月考化学试卷(解析版) 题型:推断题
(18分)氯吡格雷(clopidogrel,1)是一种用于抑制血小板聚集的药物,根据原料的不同,该药物的合成路线通常有两条,其中以2-氯苯甲醛为原料的合成路线如下:
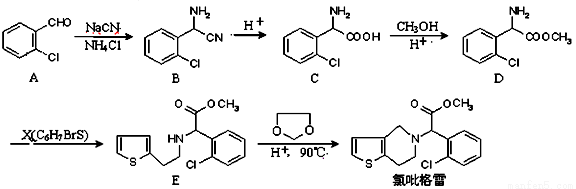
(1)C→D的反应类型是 反应。
(2)X的结构简式为 。
(3)两分子C可在一定条件下反应,生成的有机产物分子中含有3个六元环,写出该反应的化学方程式 。
(4)已知:①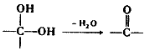
② 中氯原子较难水解
中氯原子较难水解
物质A(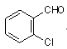 )可由2—氯甲苯为原料制得,写出以两步制备A的化学方程式__________。该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式___________。
)可由2—氯甲苯为原料制得,写出以两步制备A的化学方程式__________。该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式___________。
(5)物质C的某种同分异构体G满足以下条件:
①结构中存在氨基;
②苯环上有两种不同化学环境的氢;
③G能发生银镜反应,其碱性条件下水解的两种产物也能发生银镜反应;
写出符合条件的G的可能的结构简式:_________________________。
(6)已知:
写出由乙烯、甲醇为有机原料制备化合物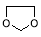 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
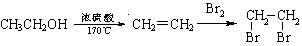
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
设阿伏加德罗常数为NA,下列说法正确的是
A.1mol Cl2与足量Fe反应,转移的电子数为3NA
B.20g重水(D2O)中含有的中子数为8 NA
C.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
D.标准状况下,22.4L已烷中共价键数目为19NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:选择题
下列有关电解质溶液中粒子浓度关系正确的是
A.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
C.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液: 2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:实验题
(14分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO23H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏
b.蒸发
c.灼烧
d.过滤
e.冷却结晶
要得到更纯的NaClO23H2O晶体必须进行的操作是 (填操作名称)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列说法中不正确的是
A.绿色化学的核心是从源头上消除工业生产对环境的污染。
B.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。
D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川一中高三第二次模拟考试 理综化学试卷(解析版) 题型:实验题
(15分)某研究小组从一含锌废渣(质量百分组成:40.5%ZnO 、19.5%CuO、5.7%FeO、7.3% Fe2O3,其余为SiO2)中回收锌和铜,设计以工业废酸(含15%的H2SO4)为酸浸液的方案,其流程如下图(部分条件略):已知碱式碳酸锌的化学式为Zn(OH)2·ZnCO3。
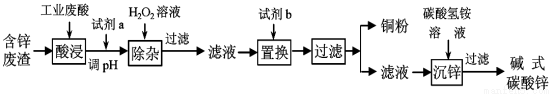
部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
离子 | Fe2+ | Fe3+ | Cu2+ |
开始沉淀时的pH(初始浓度为1.0 mol/L) | 6.5 | 1.5 | 4.2 |
沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
请回答下列问题:
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+ 或Zn(OH)42 -(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5molL-1时,Zn2+离子已沉淀完全).
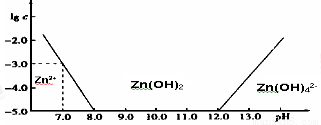
利用图中数据计算,Ksp[Zn(OH)2]= 。
(2)写出试剂a、b的化学式:a: ;b: 。
(3)写出加入H2O2后发生反应的离子反应方程式: 。
(4)写出沉锌过程中的离子反应方程式: ,沉锌后溶液中主要溶质的化学式是 。
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应。写出碱式碳酸锌受热分解的化学方程式 。
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______ (填“能”或“否”)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
某学习小组的同学在学习了化学反应速率与化学平衡知识后,对反应:aA(g)+bB(g) cC(g)+dD(g)
cC(g)+dD(g) 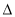 H,反应特点与对应的图象展开了讨论,其中不正确的是
H,反应特点与对应的图象展开了讨论,其中不正确的是
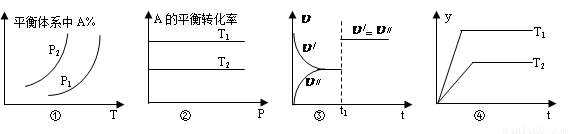
A.图①中,若P1>P2,则该反应在较低温度下有利于自发进行
B.图②中,若T2>T1,则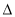 H<0且a+b=c+d
H<0且a+b=c+d
C.图③中(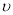 /表示正反应速率,
/表示正反应速率,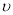 //表示逆反应速率),t1时刻改变的条件一定是使用了催化剂
//表示逆反应速率),t1时刻改变的条件一定是使用了催化剂
D.图④中,若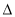 H<0,则纵坐标不可能表示的是反应物的转化率
H<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com